MONARCH 3: Risultati dell’analisi finale della sopravvivenza globale presentati al San Antonio Breast Cancer Symposium (SABCS) il 6 dicembre 2023.
Lo studio clinico di fase III randomizzato un doppio ciclo MONARCH 3 ha arruolato (Nov 2014-Nov 2015) 493 pazienti in post-menopausa con carcinoma mammario avanzato non pretrattate nel settimo metastatico e con malattia endocrino-sensibile (ripresa di malattia>12 mesi dal termine della ET adiuvante o malattia metastatica de novo). Le pazienti (~40% con malattia metastatica de novo e ~60% con ripresa di carcinoma mammario precedentemente diagnosticato) sono state randomizzate (2:1) a ricevere abemaciclib (150 mg/os/ due volte al giorno) oppure placebo in combinazione e NSAI (letrozolo o anostrozolo). L’endpoint primario era la PFS valutata dagli investigatori. I risultati ad un follow up mediano di 17,8 mesi (GOETZ M.P. et al, JCO 2017) avevano evidenziato un vantaggio statisticamente significativo in PFS con l’aggiunta di abemaciclib all’ET (HR=0,54; 95% CI 0,41-0,72; p=0,000021). Relativamente alla safety:
- la diarrea è stato l’effetto collaterale più frequente (81,3%) nel gruppo abemaciclib, ma di grado 1 nel 44,6% dei casi;
- tra gli eventi più avversi più frequenti di grado 3 e 4 sono stati riportati neutropenia (21,1% con abemaciclib vs 1,2% placebo), diarrea (9,5% vs 1,2%) e leucopenia (7,6% vs 0,6%).
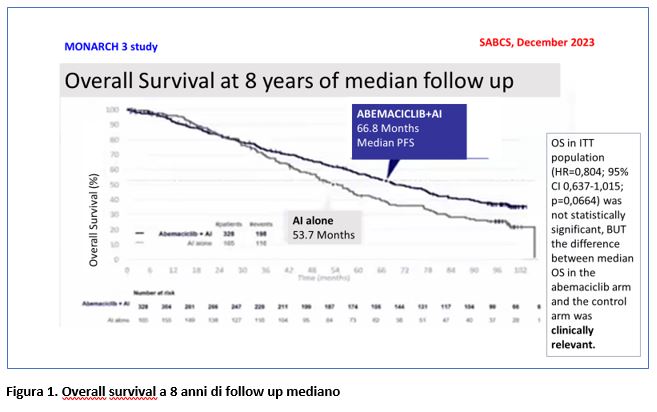
Al San Antonio Breast Cancer Symposium (SABCS), il 6 dicembre 2023, è stata presentata l’analisi finale della Overall Survival a 8 anni di follow up (GOETZ M.P. et al, Abstract GS01-13).
In questa recente analisi la OS mediana è stata di 66,8 mesi nel gruppo abemaciclib+ET vs 53,7 mesi nel gruppo placebo+ET (HR=0,804; 95% CI 0,637-1,015; p=0,0664), con una differenza quindi statisticamente non significativa, ma clinicamente molto importante (differenza in termini assoluti è di 13,1 mesi nella popolazione ITT) (Figura 1). Il vantaggio in OS con abemaciclib è stato riportato nell’analisi di sottogruppo.
Nelle pazienti con metastasi viscerali il vantaggio in OS, sebbene non statisticamente significativo (HR=0,758; 95% CI 0,55-1,030; p=0,0757) è risultato importante con abemaciclib: 63,7 mesi vs 48,8 mesi.
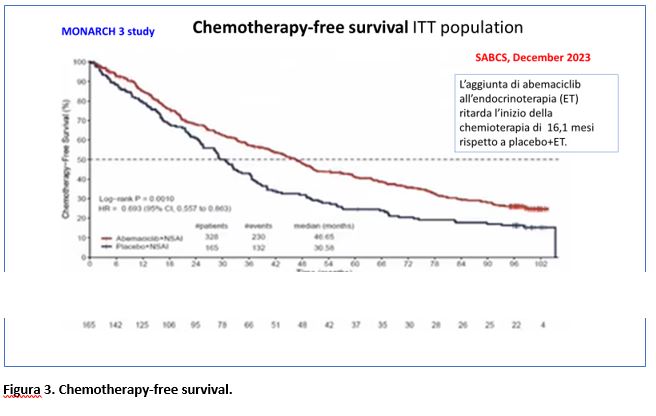
Il beneficio di abemaciclib in PFS (endpoint primario dello studio) è risultato essere stato mantenuto, con 29 mesi di PFS mediana nel gruppo abemaciclib+ET vs 14,8 mesi nel gruppo placebo+ET (HR=0,535; 95% CI 0,429-0,668; p<0,0001). Il tasso di PFS a 6 anni era del 23,3% per le pazienti trattate con abemaciclib+ET vs il 4,3% del gruppo placebo+ET (Figura 2). Non sono stati riportati nuovi dati relativi alla safety. Inoltre, l’aggiunta di abemaciclib alla ET (NSAI) allunga il tempo all’inizio della chemioterapia, con un aumento di 16,1 mesi della «median chemotherapy-free survival», altro dato importante per la pratica clinica (Figura 3).
COMMENTO
A 8 anni di follow up, lo STUDIO Monarch3 conferma di essere un trial positivo per i motivi sotto elencati.
- L’endpoint primario PFS ha raggiunto la significatività STATISTICA e la PFS continua a dimostrare nel tempo una separazione delle curve, con 23,3% di pazienti libere da progressione a 6 anni nekl gruppo abemaciclib+ET vs 4,3% nel gruppo placebo + ET.
- L’ Overall Survival (endpoint secondario) non ha raggiunto la significatività statistica, ma è comunque clinicamente rilevante perché:
- 66,8 mesi di OS mediana ottenuta con abemaciclib è la più lunga OS riportata tra le pazienti con malattia endocrino-sensibile utilizzando CDK4/6I in prima linea;
- è stato osservato un vantaggio in termini assoluti di 13,1 mesi in OS con abemaciclib;
- è stato riportato un vantaggio in termini assoluti di 14,9 mesi in OS nelle pazienti con metastasi viscerali.
Bibliografia
Goetz M.P. et al. MONARCH 3: Abemaciclib as initial therapy for advanced breast cancer.
JCO 2017; 32: 3638-3646. https://pubmed.ncbi.nlm.nih.gov/28968163/
Goetz M.P. et al. MONARCH 3: Final overall survival results of abemaciclib plus a nonsteroidal aromatase inhibitor as first-line therapy for HR+, HER2- advanced breast cancer. SABCS 2023, abstract GS01-13
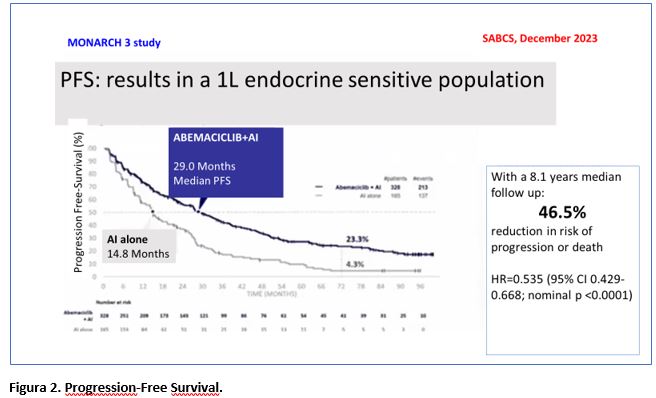
L’impatto clinico di Abemaciclib è stato confermato come clinicamente rilevante (differenza assoluta di 14,2 mesi). A 6 anni, sono libere da progressione oltre il 23% delle pazienti del gruppo Abemaciclib vs 4% del gruppo di controllo.