ENFORTUMAB VEDOTIN AND PEMBROLIZUMAB IN UNTREATED ADVANCED UROTHELIAL CANCER.
Powles T, Valderrama BP, Gupta S, Bedke J, Kikuchi E, Hoffman-Censits J, Iyer G, Vulsteke C, Park SH, Shin SJ, Castellano D, Fornarini G, Li JR, Gümüş M, Mar N, Loriot Y, Fléchon A, Duran I, Drakaki A, Narayanan S, Yu X, Gorla S, Homet Moreno B, van der Heijden MS; EV-302 Trial Investigators
N Engl J Med 2024;390:875-88. DOI: 10.1056/NEJMoa2312117
Ad oggi, nessun trattamento antiblastico aveva evidenziato un così significativo vantaggio in sopravvivenza globale e progression free survival , rispetto ad una chemioterapia a base di platino (cis- o carboplatino), in pazienti da carcinoma uroteliale localmente avanzato o metastatico precedentemente non trattato.
METODI
Lo studio EV-302 di fase 3, open, randomizzato, ha confrontato l’efficacia e la sicurezza di enfortumab vedotin + pembrolizumab rispetto ad una chemioterapia a base di platino in pazienti con carcinoma uroteliale avanzato o metastatico non pretrattato.
I pazienti sono stati randomizzati (1:1) a ricevere (Figura 1):
- enfortumab vedotin-pembrolizumab
- chemioterapia a base di platino (cis- o carbo platino e gemcitabina).
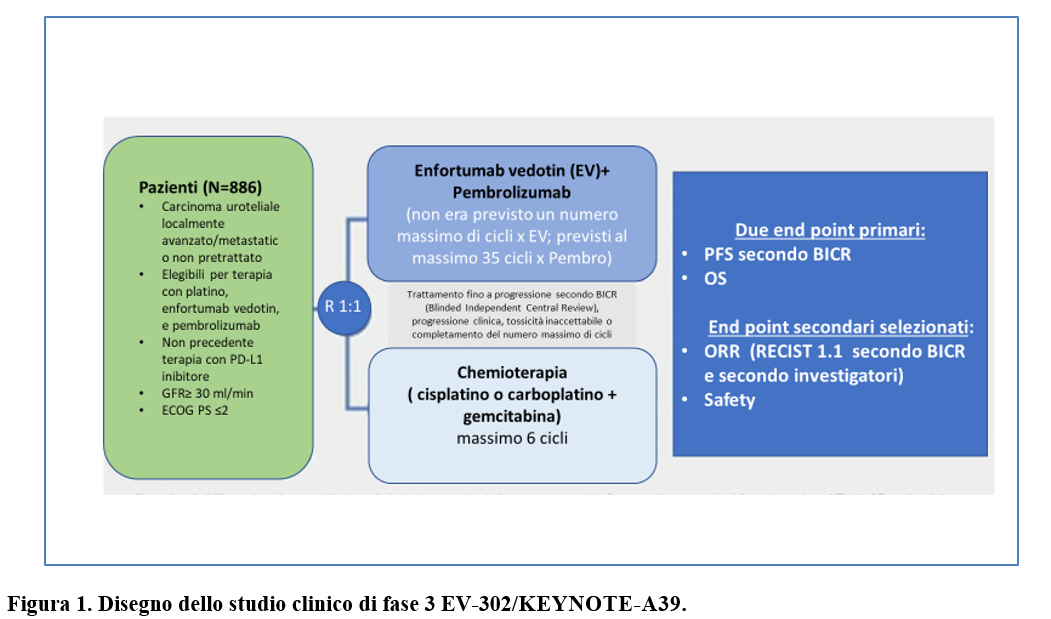
Nel gruppo enfortumab vedotin-pembrolizumab i pazienti ricevevano enfortumab vedotin (alla dose di 1,25 mg per chilogrammo di peso corporeo per via endovenosa nei giorni 1 e 8, con una dose massima di 125mg, + pembrolizumab (alla dose di 200 mg per via endovenosa nei giorni 1 e 8)- cicli ogni 3 settimane; nel gruppo chemioterapia i pazienti ricevevano gemcitabina+ cisplatino oppure carboplatino (in base all’idoneità a ricevere cisplatino)- cicli ogni 3 settimane. Le dosi dei chemioterapici erano: gemcitabina 1000 mg/mq/iv -die 1 e 8; cisplatino 70 mg/mq/iv -die 1; carboplatino AUC 4,5-5/iv-die 1.
L’idoneità a ricevere cisplatino veniva valutata in base ai criteri di Galsky (Galsky MD, 2011).
I due end point primari dello studio erano la sopravvivenza libera da progressione (valutata da una revisione centrale indipendente in cieco) e la sopravvivenza globale.
Gli end point secondari selezionati erano la risposta obiettiva (RECIST 1.1) valutata dal BICR, la durata della risposta, il tempo al peggioramento del dolore e la safety.
RISULTATI
Sono stati randomizzati (1:1) 886 pazienti: 442 al gruppo enfortumab vedotin+ pembrolizumab e 444 al gruppo chemioterapia.
Il 95% dei pazienti arruolati nello studio era in fase metastatica; circa i 3/4 dei pazienti aveva una neoplasia uroteliale del basso tratto urinario e oltre l’80% aveva una istologia di carcinoma uroteliale; il 72% aveva metastasi viscerali. Il 58% dei tumori aveva CPS ≥10 e il 42% CPS <10 (l’espressione di PD-L1 era stata valutata con test IHC 22C3 di Agilent).
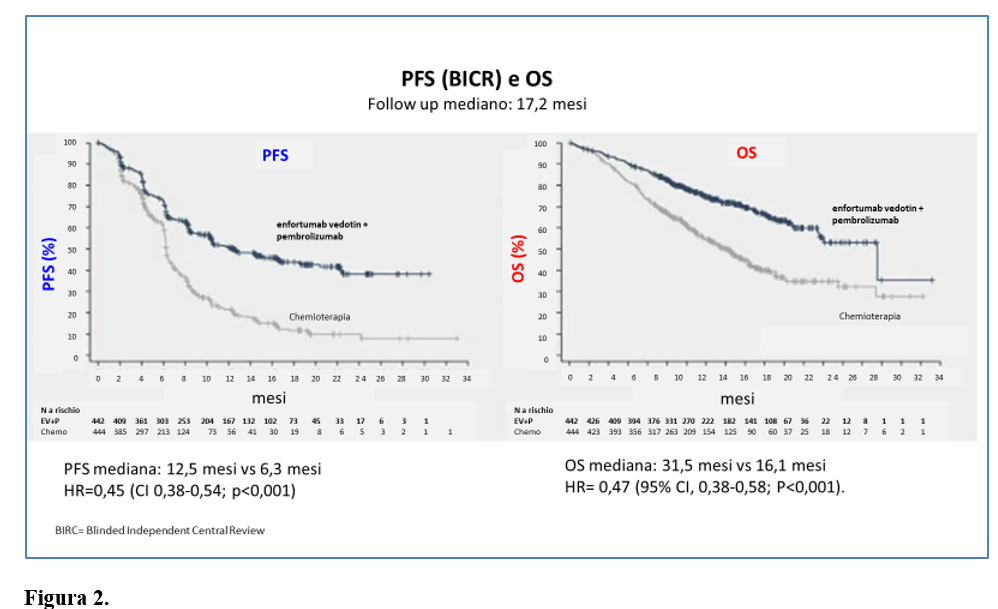
All'8 agosto 2023, la durata mediana del follow-up per la sopravvivenza era di 17,2 mesi.
La sopravvivenza libera da progressione e la sopravvivenza globale sono risultate più lunghe nel gruppo enfortumab vedotin+pembrolizumab rispetto al gruppo chemioterapia (Tabella 1 e Figura 2).

Il numero mediano di cicli è stato di 12 (range,1 a 46) nel gruppo EV+P e di 6 (range, 1-6) nel gruppo chemioterapia.
La risposta obiettiva è stata più alta nel gruppo EV+P rispetto al gruppo chemioterapia (67,7% vs 44,4%; 95% CI 39,7-49,2; p<0,001), con tasso di risposte complete del 29,1% vs 12,5%. La percentuale di pazienti ancora in risposta a 18 mesi era più alta nel gruppo EV+P rispetto al gruppo chemioterapia (59.6% vs 19.3%) Il tempo mediano alla risposta è risultato sovrapponibile nei due gruppi (2,1 mesi) e la durata mediana della risposta non è stata ancora raggiunta nel gruppo EV+P (95% CI 20,2-NE) e d è stata di 7 mesi (95% CI 6,2-10,2) nel gruppo chemioterapia. Eventi avversi correlati al trattamento di grado ≥ 3 si sono verificati nel 55,9% dei pazienti del gruppo EV+P e nel 69,5% di quelli del gruppo chemioterapia.
CONCLUSIONI
Il trattamento con enfortumab vedotin + pembrolizumab ha determinato esiti significativamente
migliori rispetto alla chemioterapia nei pazienti con neoplasia uroteliale localmente avanzata o metastatica non pretrattato, con un profilo di safety coerente con quanto precedentemente pubblicato.
AGGIORNAMENTO ALL’ASCO GU 2024
All’ASCO GU a gennaio 2024 sono state presentate da Van der Heijden le analisi di sottogruppo prespecificate ( riportate peraltro anche nell’articolo pubblicato nel NEJM 2024) e sono state riportate le curve di PFS (metastasi epatiche, eleggibilità al cisplatino, stato di PD-L1) e OS (metastasi epatiche).
Il beneficio di enfortumab vedotin+pembrolizumab in tutti i sottogruppi prespecificati è risultato consistente con quello osservato nella popolazione generale.
COMMENTO
In Italia Enfortumab vedotin è attualmente rimborsato SOLO come monoterapia per il trattamento di pazienti pretrattati.
EMA ha approvato il farmaco in base ai risultati dello studio internazionale di fase 3 EV-301 che ha dimostrato un beneficio in OS rispetto alla chemioterapia ( Powles T el al; NEJM 2021).
AIFA con Determina n. 458/2023 (pubblicata su GU del 12 luglio 2023) ha approvato la rimborsabilità di Enfortumab vedotin in monoterapia per il trattamento di pazienti adulti con carcinoma uroteliale localmente avanzato o metastatico che hanno precedentemente ricevuto una chemioterapia contenente platino e un inibitore di PD-1 o PD-L1.
BIBLIOGRAFIA
Galsky MD, et al. Treatment of patients with metastatic urothelial cancer “unfit” for Cisplatin-based chemotherapy. J Clin Oncol. 2011 Jun 10;29(17):2432-8. doi: 10.1200/JCO.2011.34.8433. Epub 2011 May 9. PMID: 21555688.
Van der Heijden M. et al. nfortumab vedotin (EV) in combination with pembrolizumab (P) versus chemotherapy in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC): Subgroup analyses results from EV-302, a phase 3 global study. ASCO GU 2024. LBA 530.
Powles T, et al. Enfortumab Vedotin in Previously Treated Advanced Urothelial Carcinoma. N Engl J Med 2021; 384:1125-1135. DOI: 10.1056/NEJMoa2035807
Link all’abstract



