DOSTARLIMAB FOR PRIMARY ADVANCED OR RECURRENT ENDOMETRIAL CANCER.
Mirza MR, et al. N Engl J Med 2023; ;388:2145-58. DOI: 10.1056/NEJMoa2216334
Per il cancro endometriale primario avanzato o ricorrente, la terapia con carboplatino e paclitaxel rappresenta ancora la prima linea di trattamento, con una sopravvivenza globale mediana inferiore a 3 anni.
Dostarlimab è un inibitore del checkpoint immunitario che si lega al recettore PD-1.
La combinazione di immunoterapia e chemioterapia può avere effetti sinergici nel trattamento del tumore dell’endometrio.
METODI
E’ stato condotto uno studio di fase 3, internazionale, in doppio cieco, randomizzato e controllato con placebo (ENGOT-EN-6-NSGO/GOG-3031/RUBY trial) che ha arruolato pazienti con carcinoma endometriale primario avanzato in stadio III o IV o con prima recidiva.
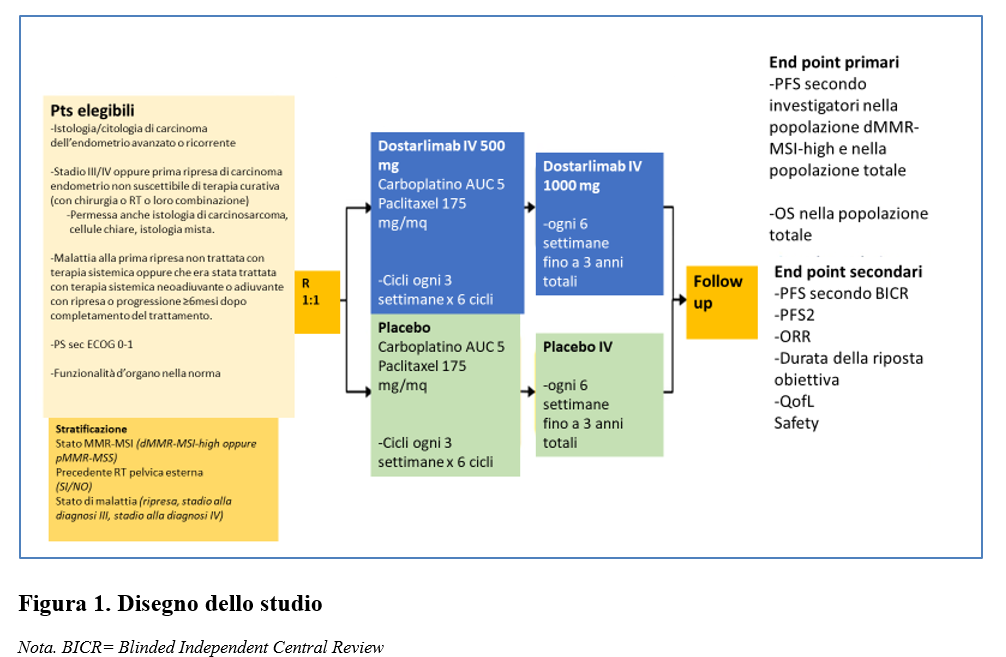
Le pazienti sono state randomizzate (1:1) e sono state assegnate a ricevere:
– dostarlimab (500 mg)+ carboplatino (AUC 5) e paclitaxel (175 mg/mq)-ogni 3 settimane -x 6 cicli seguiti da dostarlimab (1000 mg) ogni 6 settimane per un massimo di 3 anni
oppure
– placebo+ carboplatino (AUC 5) e paclitaxel (175 mg/mq)-ogni 3 settimane -x 6 cicli seguiti da placebo ogni 6 settimane per un massimo di 3 anni (Figura 1).
Gli end point primari erano:
-la sopravvivenza libera da progressione valutata dallo sperimentatore secondo i criteri RECIST 1.1 nella popolazione con dMMR (mismatch repair-deficient)- MSI-H( microsatellite instability-high) e nella popolazione totale;
-la sopravvivenza globale nella popolazione globale.
Gli endpoint secondari includevano anche la PFS valutata dal BICR, la risposta obiettiva, il controllo di malattia, la durata della risposta.
È stata inoltre valutata la safety.
RISULTATI
Delle 494 pazienti randomzizate, 118 (23,9%) avevano tumori mismatch
repair-deficient (dMMR), tumori ad alta instabilità microsatellitare (MSI-H).
Nella popolazione dMMR-MSI-H, la sopravvivenza libera da progressione stimata a 24 mesi è stata del 61,4% (95% CI 46,3-73,4) nel gruppo dostarlimab e 15,7% (95% CI, da 7,2 a 27,0) nel gruppo placebo (HR= 0,28; 95% CI 0,16-0,50; p<0,001). Nella popolazione complessiva, la sopravvivenza libera da progressione a 24 mesi è stata del 36,1% (95% CI 29,3-42,9) nel gruppo dostarlimab e del 18,1% (95% CI 0,16- 0,50; p<0,001). e 18,1% (95% CI, 13,0-23,9) nel gruppo placebo (hazard ratio, 0,64; 95% CI, 0,51-0,80; p<0,001). La sopravvivenza globale a 24 mesi è stata del 71,3% (95% CI, 64,5-77,1) con dostarlimab e del 56,0% (95% CI, 48,9-62,5) con placebo (HR= 0,64; 95% CI, 0,46-0,87). Gli eventi avversi più comuni che si sono verificati o sono peggiorati durante il trattamento sono stati la nausea (53,9% dei pazienti del gruppo dostarlimab e il 45,9% di quelli del gruppo placebo), alopecia (53,5% e 50,0%) e fatigue (51,9% e 54,5%). Gli eventi avversi gravi e severi sono stati più frequenti nel gruppo dostarlimab rispetto al gruppo placebo.
CONCLUSIONI
Dostarlimab più carboplatino-paclitaxel ha aumentato in modo significativo la sopravvivenza libera da progressione sopravvivenza libera da progressione tra le pazienti con carcinoma endometriale primario avanzato o ricorrente, con un beneficio sostanziale nella popolazione dMMR-MSI-H.
COMMENTO
Dal 6 marzo 2024 è attivo in Italia l’Expanded Access Program (EAP) di dostarlimab in associazione a carboplatino e paclitaxel per il trattamento di pazienti adulte affette da cancro endometriale (CE) primario avanzato o ricorrente con deficit del sistema di mismatch repair (dMMR)/elevata instabilità dei microsatelliti (MSI-H) e che sono candidate a terapia sistemica.
Link all’abstract
https://pubmed.ncbi.nlm.nih.gov/36972026/



