
RIPRETINIB IN PATIENTS WITH ADVANCED GASTROINTESTINAL STROMAL TUMOURS (INVICTUS): A DOUBLE-BLIND, RANDOMISED, PLACEBO-CONTROLLED, PHASE 3 TRIAL.
Blay JY, Serrano C, Heinrich MC, Zalcberg J, Bauer S, Gelderblom H, Schöffski P, Jones RL, Attia S, D’Amato G, Chi P, Reichardt P, Meade J, Shi K, Ruiz-Soto R, George S, von Mehren M.
Lancet Oncol. 2020 Jul;21(7):923-934. doi: 10.1016/S1470-2045(20)30168-6
Free PMC article
La resistenza agli inibitori del recettore tirosin-chinasico (KIT) e del recettore α del fattore di crescita derivato dalle piastrine (PDGFRA) rappresenta un problema per i pazienti con tumori stromali gastrointestinali avanzati. Per questo motivo è stato condotto questo studio clinico randomizzato, internazionale, che ha confrontato l’efficacia e la sicurezza di ripretinib, un inibitore della tirosin-chinasi attivo contro un ampio spettro di mutazioni di KIT e PDGFRA, rispetto a placebo in pazienti con tumori stromali gastrointestinali avanzati pretrattati.
METODI
In questo studio di fase 3, in doppio cieco, randomizzato e controllato con placebo, sono stati arruolati pazienti adulti di età uguale o superiore a 18 anni, affetti da tumori stromali gastrointestinali avanzati in progressione dopo imatinib, sunitinib e regorafenib. o intolleranza documentata a uno qualsiasi di questi farmaci nonostante le modifiche di dose. I pazienti dovevano avere ECOG PS pari a 0-2. I pazienti elegibili sono stati randomizzati (2:1) a ricevere ripretinib (150 mg/os/ una volta al giorno)+ best supportive care oppure placebo (una volta al giorno)+ best supportive care (Figura 1).
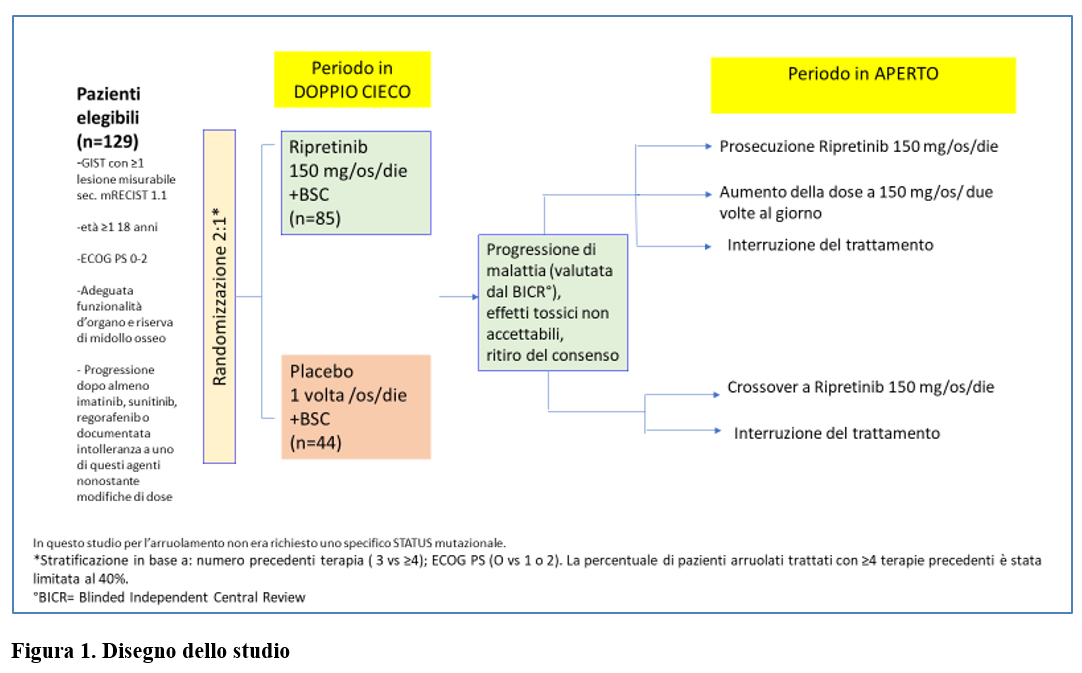
La randomizzazione prevedeva una stratificazione in base al numero di terapie precedenti e al PS secondo ECOG. I pazienti, gli sperimentatori, il personale di ricerca e il team dello studio sponsor non erano a conoscenza del braccio di trattamento al quale ogni paziente era stato assegnato fino a quando la revisione centrale indipendente in cieco (BICR) non avesse evidenziato progressione di malattia (studio in doppio cieco).
L’endpoint primario era la sopravvivenza libera da progressione, valutata dal BICR (Blinded Independent Central Review) secondo mRECIST 1.1. La PFS era l’intervallo tra la randomizzazione e la data di progressione documentata di malattia o morte per qualsiasi causa).
L’end poitnt secondario chiave era il tasso di risposte obiettive (valutate dal BICR). Tra gli altri end point secondari, erano compresi la sopravvivenza globale (intervallo tra la data della radndomizzazione e la data della morte per qualsiasi causa) e il time to progression (intervallo tra randomizazione e data di progressione documentata dal BICR).
L’analisi primaria è stata effettuata nella popolazione secondo “intention-to-treat analysis” e la tossicità è stata valutata nei pazienti che avevano ricevuto almeno una dose del farmaco in studio.
Al momento della progressione di malattia, il cieco veniva aperto e ai pazienti in trattamento con ripretinib veniva offerta la possibilità di continuare ripretinib (alla stessa dose o a dose raddoppiata) e ai pazienti del gruppo placebo veniva offerta la possibilità di iniziare ripretrinib (Figura 1).
(Lo studio INVICTUS è registrato su ClinicalTrials.gov, con il numero NCT03353753, e su WHO International Clinical Trials Registry Platform, con il numero EUCTR2017-002446-76-ES).
Il follow-up è tutt’ora in corso.
RISULTATI
Tra il 27 febbraio 2018 e il 16 novembre 2018, 129 dei 154 pazienti valutati sono stati randomizzati a ricevere ripretinib (n=85) o placebo (n=44).
Alla data di chiusura dei dati (31 maggio 2019), con un follow-up mediano di 6,3 mesi (IQR 3,2-8,2) nel gruppo trattato con ripretinib e di 1,6 mesi (1,1-2,7) nel gruppo placebo, 51 pazienti nel gruppo sperimentale e 37 nel gruppo placebo avevano manifestato eventi per la PFS.
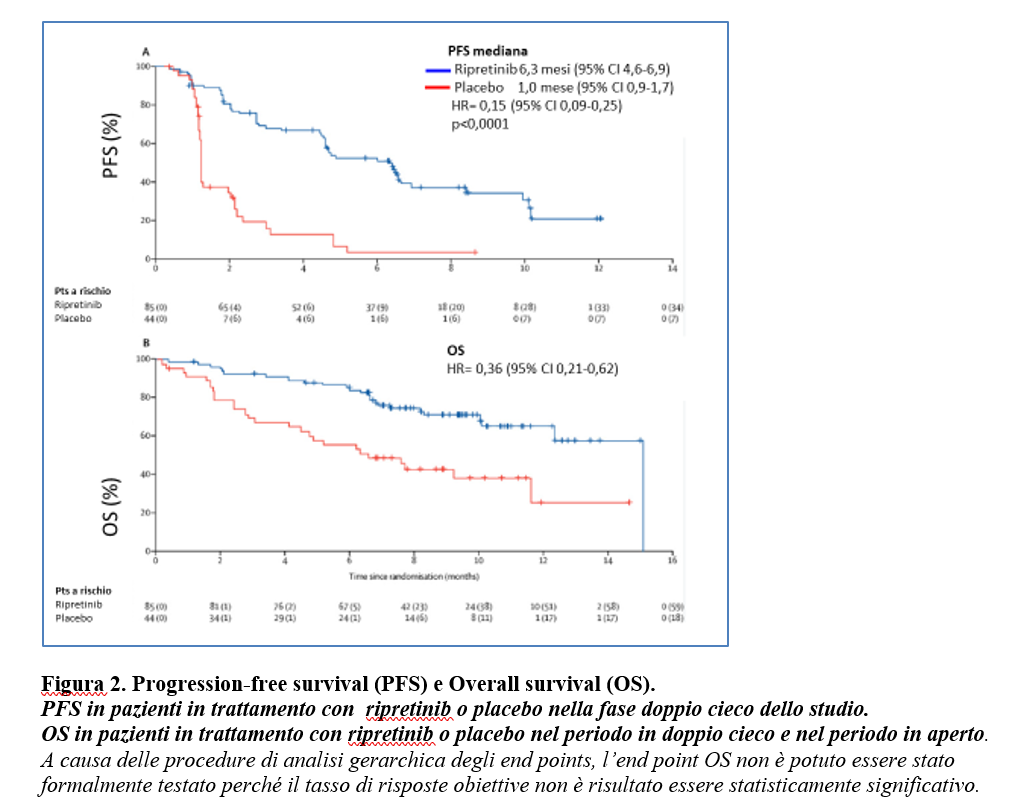
Nel periodo di trattamento in doppio cieco, la PFS è stata di 6,3 mesi (95% CI 4,6-6,9) con ripretinib rispetto a 1,0 mesi (0,9-1,7) con placebo (HR=0,15, 95% CI 0,09-0,25; p<0,0001) (Figura 2).
Il tasso di risposte obiettive è stato del 9% nel gruppo ripretinib vs 0% nel gruppo placebo (p value di 0,0504). Stabilità di malattia è stata riportata nel 47% dei pazienti trattati con ripretinib vs 5% del gruppo placebo. Progressione di malattia è stata riportata nel 19% dei pazienti trattati con ripretinib vs 64% del gruppo placebo.
Il tempo mediano alla progressione con ripretinib è stato di 6,4 mesi (95% ci 4,6-8,4) rispetto a 1,0 mesi nel gruppo placebo (ci 95% 0,9-1,7).
La sopravvivenza globale mediana- comprendente sia il periodo di doppio cieco che il periodo in aperto- è stata di 15,1 mesi 95% CI 12,3-15,1) nel gruppo ripretinib vs 6,6 mesi (95% CI 0,21-0,62) nel gruppo placebo (95% CI 4,1-11,6) con HR= 0,36, 95% CI 0,21-0,62) (Figura 2). A causa delle procedure di analisi gerarchica degli end points, l’end point OS non è potuto essere stato formalmente testato per significatività statistica perché il tasso di risposte obiettive non è risultato essere significativo.
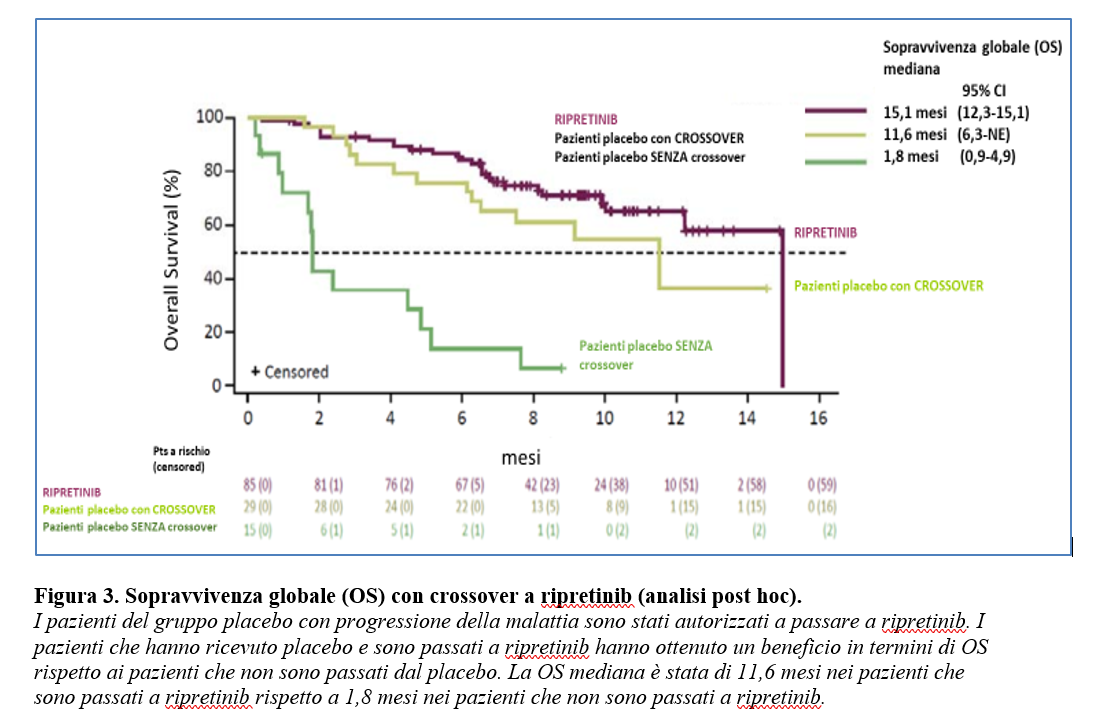
Ad una analisi post hoc eseguita nei pazienti del gruppo placebo che al momento della progressione hanno eseguito cross over a ripretinib rispetto a quelli che non sono passati a ripretinib ( riportata nel materiale supplementare) si evidenzia un beneficio in termini di O con una sopravvivenza globale mediana è stata di 11,6 mesi nei pazienti che sono passati a ripretinib rispetto a 1,8 mesi nei pazienti che non sono passati a ripretinib (Figura 3).
Gli eventi avversi di grado 3 o 4 correlati al trattamento più comuni (>2%) nel gruppo ripretinib (n pazienti=85) comprendevano aumento della lipasi (quattro [5%]), ipertensione (tre [4%]), fatigue (due [2%]) e ipofosfatemia (due [2%]).
Nel gruppo placebo (n pazienti=43), gli eventi avversi di grado 3 o 4 correlati al trattamento più comuni (>2%) sono stati anemia (tre [7%]), fatigue (uno [2%]), diarrea (uno [2%]), diminuzione dell’appetito (uno [2%]), disidratazione (uno [2%]), iperkaliemia (uno [2%]), insufficienza renale acuta (uno [2%]) ed edema polmonare (uno [2%]).
Eventi avversi gravi correlati al trattamento sono stati riportati in 8 (9%) degli 85 pazienti che hanno ricevuto ripretinib e in 3 (7%) dei 43 pazienti trattati con placebo.
I decessi correlati al trattamento si sono verificati in un paziente del gruppo placebo (shock settico ed edema polmonare) e in un paziente del gruppo ripretinib (causa della morte sconosciuta per decesso durante il sonno).
CONCLUSIONI
Il trattamento con Ripretinib ha migliorato significativamente la sopravvivenza mediana libera da progressione rispetto a placebo nei pazienti con tumori stromali gastrointestinali avanzati (GIST) resistenti a imatinib, sunitinb, regorafenib.
COMMENTO
Il vantaggio di ripretinib è stato riportato anche in sopravvivenza globale (OS) con un valore mediano di 15,1 mesi rispetto ai 6,6 mesi del gruppo placebo. Anche se a causa delle procedure di analisi gerarchica degli end points, l’end point OS non è potuto essere stato formalmente testato per significatività perché il tasso di risposte obiettive non è risultato essere significativo, va sottolineato che nei precedenti studi con sunitinb e con regorafenib utilizzati in 2a o 3a linea dopo progressione di malattia, i vantaggi in sopravvivenza globale verso placebo sono stati modesti e non significativi.
Un’analisi aggiornata 19 mesi dopo l’analisi primaria, ha mostrato una durata di OS ancora più lunga per ripretinib, con una durata mediana di OS di 18,2 mesi rispetto a 6,3 mesi nel braccio placebo (Mehren 2021; Thirasastr 2023).
Il trattamento con ripretinib ha mostrato un basso profilo di tossicità, risultando pertanto maneggevole oltre che efficace.
Sulla base dei risultati dello studio di fase 3 randomizzato INVICTUS, e in considerazione delle scarse opzioni terapeutiche efficaci disponibili, Ripretinib ha avuto recentemente da AIFA (Determina 6 settembre 2023) la seguente indicazione alla rimborsabilità nel “trattamento di pazienti adulti con tumore stromale gastrointestinale (GIST) avanzato che hanno ricevuto un trattamento precedente con tre o più inibitori della chinasi incluso imatinib, con inserimento nel Fondo Farmaci Innovativi
(Gazzetta Ufficiale n.216 del 19-9-2023)”.
Bibliografia
Mehren M, Heinrich M, George S, et al. Clinical benefit with ripretinib as ≥4th-line treatment in patients with advanced gastrointestinal stromal tumor: long-term update from the phase 3 INVICTUS study. Presented at CTOS 2021; November 10–13, 2021; 2021.
Thirasastr P, Somaiah N. Emerging Data on the Safety and Efficacy of Ripretinib for the Treatment of Gastrointestinal Stromal Tumors. Clin Exp Gastroenterol 2023; 16:11-19
Link all’abstract
https://pubmed.ncbi.nlm.nih.gov/32511981/
Free PMC article


