
ELACESTRANT (ORAL SERVICE ESTROGEN RECEPTOR DEGRADER) VERSUS STANDARD ENDOCRINE THERAPY FOR ESTROGEN RECEPTOR-POSITIVE, HUMAN EPIDERMAL GROWTH FACTOR RECEPTOR 2-NEGATIVE ADVANCED BREAST CANCER: RESULTS FROM THE RANDOMIZED PHASE III EMERALD TRAIL.
Bidard FC, Kaklamani VG, Neven P, Streich G, Montero AJ, Forget F, Mouret-Reynier MA, Sohn JH, Taylor D, Harnden KK, Khong H, Kocsis J, Dalenc F, Dillon PM, Babu S, Waters S, Deleu I, García Sáenz JA, Bria E, Cazzaniga M, Lu J, Aftimos P, Cortés J, Liu S, Tonini G, Laurent D, Habboubi N, Conlan MG, Bardia A.
J Clin Oncol. 2022 Oct 1;40(28):3246-3256. doi: 10.1200/JCO.22.00338. Epub 2022 May 18. Erratum in: J Clin Oncol. 2023 Aug 10;41(23):3962.
Free PMC article
Circa il 70% dei carcinomi mammari sono ER+ e HER2-negativi. Il trattamento di prima scelta nella maggior parte di queste pazienti è rappresentato dalla combinazione di terapia endocrina (inibitore dell’aromatasi o fulvestrant) e inibitore di CDK4/6.
La successiva progressione di malattia è associata allo sviluppo di resistenza alla terapia endocrina dovuta allo sviluppo di mutazioni acquisite in vari geni come HERBB2, NF1 (gene coinvolto nella codifica della proteina neurofibromina) e ESR1 (Estrogen Receptor 1, gene coinvolto nella codifica del recettore estrogenico). Le mutazioni in ESR1 determinano una attivazione estrogeno-indipendente di ER e, conseguentemente, una resistenza agli inibitori dell’aromatasi ma non agli inibitori di ER (come ad esempio i SERD, degradatori selettivi di ER).
Le mutazioni di ESR1 si sviluppano fino al 40% delle pazienti e la presenza di queste mutazioni è associata a una prognosi peggiore, tra cui una progressione più rapida e una peggiore sopravvivenza.
Elacestrant è un nuovo SERD orale che degrada i recettori estrogenici alfa in maniera dose-dipendente, inibisce la trascrizione genica di ER estradiolo-dipendente e la crescita tumorale in modelli preclinici in vitro e in vivo, anche in quelli con mutazioni di ERS1 (figura 1).
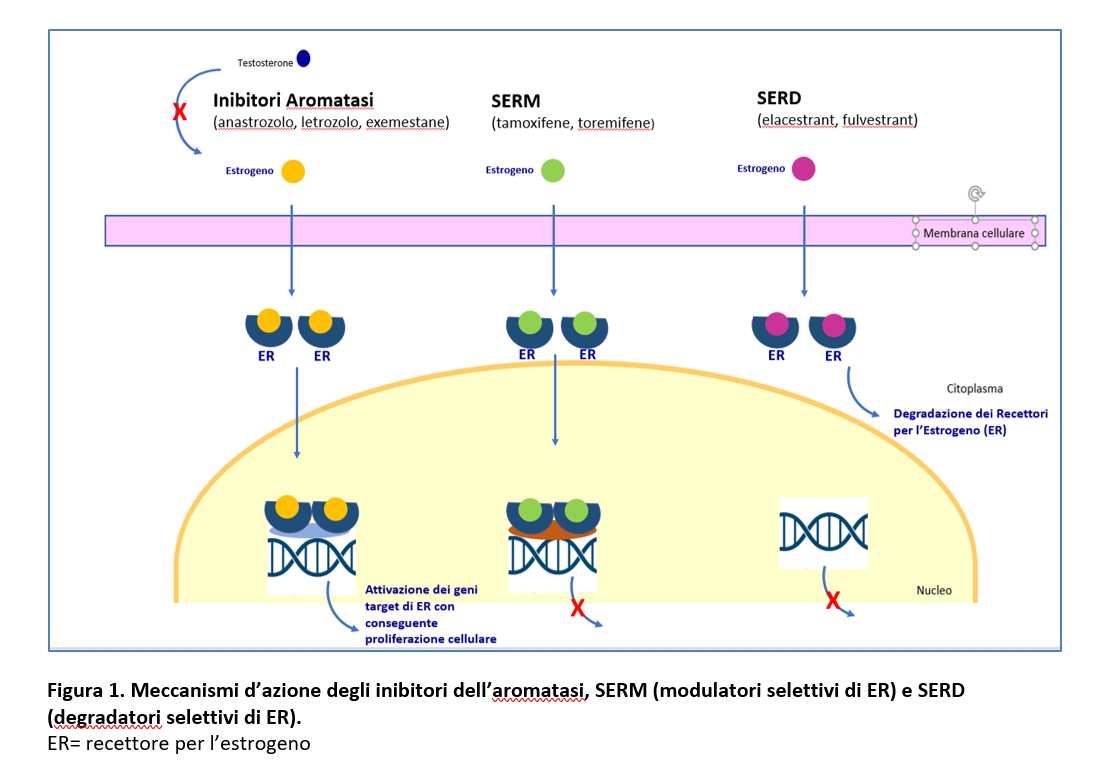
- Elacestrant è stato valutato in uno studio di fase 1 (Bardia A et al, JCO 2021) che ha arruolato 57 pazienti con carcinoma mammario localmente avanzato non operabile e/o metastatico ER-positivo/HER2 negativo , pretrattate. Delle 57 pazienti arruolate, 50 hanno ricevuto elacestrant alla dose di 400 mg/os /die.
- L’età mediana era di 63 anni (43-81); le pazienti erano state pretrattate con un numero mediano di 3 linee ( range 1-7) e con un numero mediano di 2,5 linee endocrine (range 1-7 ), inclusi inibitori delle cicline (52%). Una mutazione di ERS1 è stata rilevata nel 50% delle pazienti. La frequenza di mutazioni di ERS1 aumentava con l’aumentare del numero di precedenti linee di endocrinoterapia sottolineando l’osservazione derivante da altri studi che le mutazioni ESR1 si sviluppano generalmente durante la terapia endocrina.
- Il profilo di tossicità di elacestrant alla dose di 400 mg/os/die è stato gestibile. Gli eventi avversi più comuni sono stati: nausea (50%), dispepsia (32%), vomito (30%) e fatigue (28%). La maggior parte di questi eventi sono stati di grado 1-2. Nausea di grado 3-4 è stata riportata nel 4% dei casi e vomito nel 4%. Sono stati riportati aumenti delle transaminasi ( q.si grado per AST nel 24% e per ALT nel 18% dei casi; di grado 3-4 nell’ 8% dei casi solo per AST) e riduzione del fosforo plasmatico (q.si grado nel 20% e grado 3-4 nel 6% dei casi).
- Nella tabella 1 sono riportati i risultati dello studio di fase1 che evidenziano una attività di elacestrant in pazienti con carcinoma mammario metastatico ER+/HER2-negativo pesantemente pretratti, con un beneficio superiore di tra i pazienti con mutazione di ERS1.
- La dose raccomandata di elacestrant per studi successivi è stata di 400 mg/os/die.
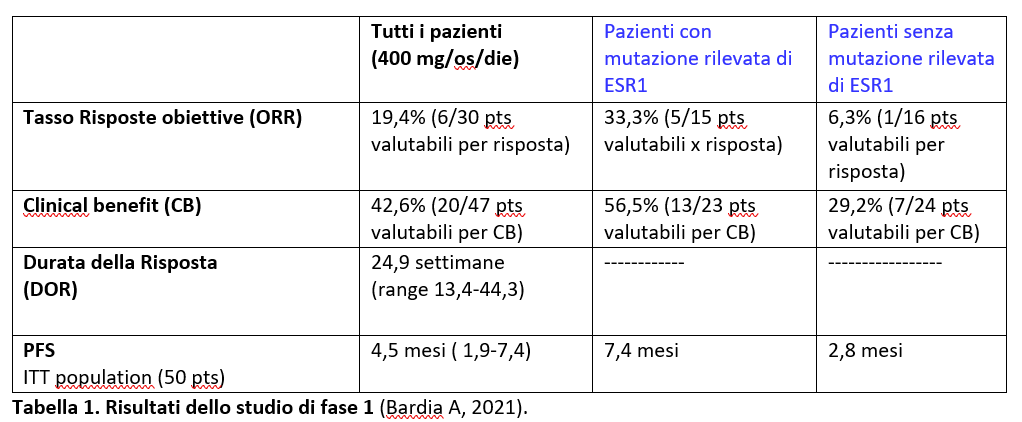
Successivamente, è stato condotto lo studio di fase 3 EMERALD (Bidard FC, JCO 2022) per confrontare efficacia e tossicità di elacestrant rispetto alla terapia endocrina scelta dallo sperimentatore in pazienti con carcinoma mammario avanzato o metastatico ER+/HER2-negativo in progressione dopo una prima o seconda linea con terapia endocrina+ inibitore di CDK4/6 e per confrontare l’efficacia tra i due tipi di trattamento in pazienti con mutazione di ESR1.

METODI
EMERALD è uno studio internazionale, multicentrico, randomizzato, open-label, di fase 3. Erano elegibili pazienti (donne in post menopausa o uomini) di età ≥ 18 anni con adenocarcinoma mammario (istologicamente o citologicamente documentato) in ripresa a livello locoregionale o metastatico (Figura 2). Venivano inclusi pazienti in progressione durante o nei 28 giorni dopo una o due linee di terapia endocrina per la malattia avanzata o metastatica, una delle quali in combinazione con inibitori di CDK4/6.
Era permessa una linea di chemioterapia per la malattia avanzata/metastatica. I pazienti dovevano avere PS ECOG 0-1. La ER-positività era definita da ≥1% di cellule positive all’IHC, con o senza positività del recettore progestinico. La HER2-negatività era definita come da linee guida correnti (Wolff AC, JCO Oncol Pract 2018; 14:437-441).
Tra i criteri di esclusione venivano riportati:
-presenza di metastasi viscerali sintomatiche;
-storia di neoplasia intraepiteliale dell’endometrio (in pazienti con utero intatto);
-altri tumori maligni nei 5 anni precedenti (ad eccezione di carcinoma basocellulare o squamocellulare adeguatamente trattato, o carcinoma in situ della cervice uterina);
– eventi cardiovascolari negli ultimi 6 mesi antecedenti l’arruolamento, quali infarto miocardico, angina severa/instabile, fibrillazione atriale non controllata (q.si grado), presenza di disritmie di grado ≥2, insufficienza cardiaca classe II o maggiore secondo la New York Heart Association, eventi cerebrovascolari, trombosi e bypass arterioso coronarico o periferico.
Nello studio EMERALD, i pazienti sono stati randomizzati (1:1) a elacestrant (400 mg/os/die) oppure a endocrinoterapia a scelta dell’investigatore (fulvestrant veniva raccomandato per pazienti non precedentemente trattati con fulvestrant; antiaromatisco veniva selezionato sulla base della precedente terapia con inibitori aromatasici) (Figura 2).
La valutazione dello stato mutazionale di ESR1 è stata effettuata nel cell-free DNA tumorale circolante (ctDNA) in campioni di sangue, in un laboratorio centralizzato. Le mutazioni ESR1 sono state definite come qualsiasi mutazione missense nei codoni 310-547.
Gli end point primari erano la PFS in tutti i pazienti e la PFS nei pazienti con mutazione ESR1 rilevata (ciascuna valutata dal Blinded Independent Central Review-BICR- secondo i criteri RECIST v1.1).
End point secondari chiave erano la sopravvivenza globale (OS) in tutti i pazienti e nei pazienti con mutazione ESR1 rilevata.
RISULTATI
Da febbraio 2019 a ottobre 2020, 477 pazienti sono stati randomizzati (R 1:1) a ricevere elacestrant (n=239 pazienti) oppure terapia endocrina a scelta dello sperimentatore (n=238 pazienti) (SOC =STANDARD OF CARE – terapia endocrina).
L’età mediana era 63 anni (24-89), 228 pazienti (47,8%) aveva mutazione ESR1 rilevata dal test e la maggior parte dei pazienti aveva metastasi viscerali (68,2% nel gruppo elacestrant e 71% nel gruppo SOC).
Altre caratteristiche sono riportate nella Tabella 2.
All’interno del gruppo SOC (n=238 pazienti), i pazienti hanno ricevuto una endocrinoterapia differente da quella precedentemente assunta: 165 sono stati trattati con Fulvestrant e 73 con un inibitore dell’aromatasi. Dei 165 pazienti trattati con fulvestrant, 83 avevano una mutazione rilevabile di ERS1 e dei 73 pazienti trattati con un inibitore dell’aromatasi 30 avevano una mutazione rilevabile di ESR1.
Nel gruppo SOC, tra i pazienti trattati con fulvestrant era maggiore la percentuale di pazienti che avevano precedentemente ricevuto una sola linea di endocrinoterapia per la malattia avanzata o metastatica rispetto ai pazienti trattati con inibitore dell’aromatasi ( 72% vs 28,8%) (Tabella 2).

Tabella 2. Caratteristiche dei pazienti arruolati nello studio EMERALD.
La PFS valutata dal BICR è risultata statisticamente aumentata nel gruppo Elacestrant vs SOC in tutti i pazienti (HR=0,70; 95% CI 0,55-0,88; p 0,0018) e nei pazienti con mutazione ESR1 rilevata (HR=0,55; 95% CI; 0,39-0,77; p=0,0005) (Tabella 3).
Le curve di PFS evidenziano una caduta iniziale in entrambi i gruppi, sottolineando la possibile endocrino-resistenza nella 2a e 3a linea di trattamento, ma poi le curve si separano nettamente (Figura1).
Poiché la sola PFS mediana può essere fuorviante in questo scenario, è stata condotta una LANDMARK analisi a 6 mesi e a 12 mesi (vengono quindi valutati i pazienti vivi a 6 mesi e a 12 mesi) (Tabella 3).
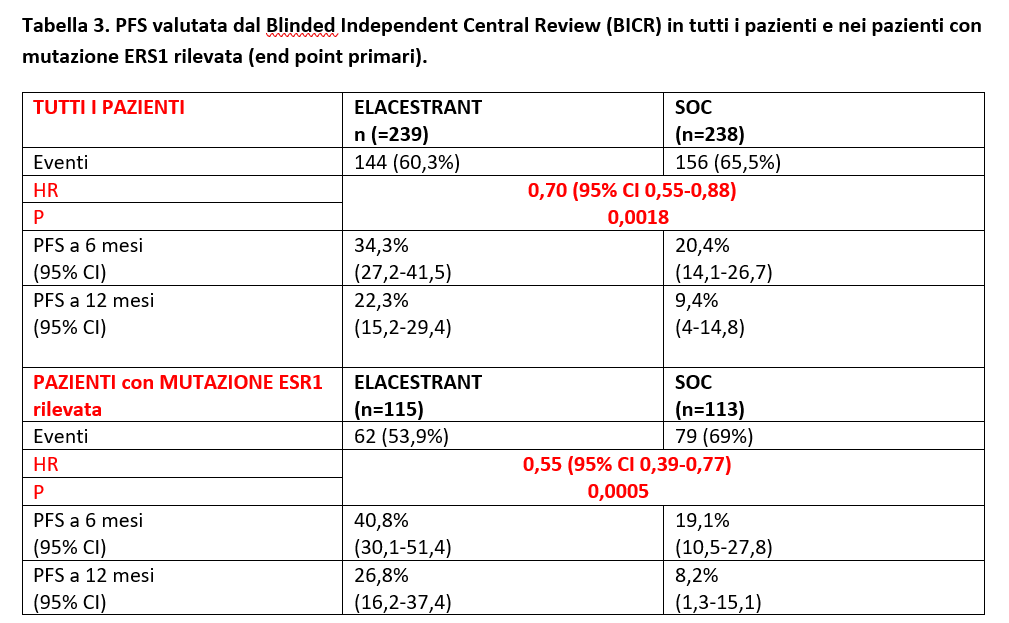
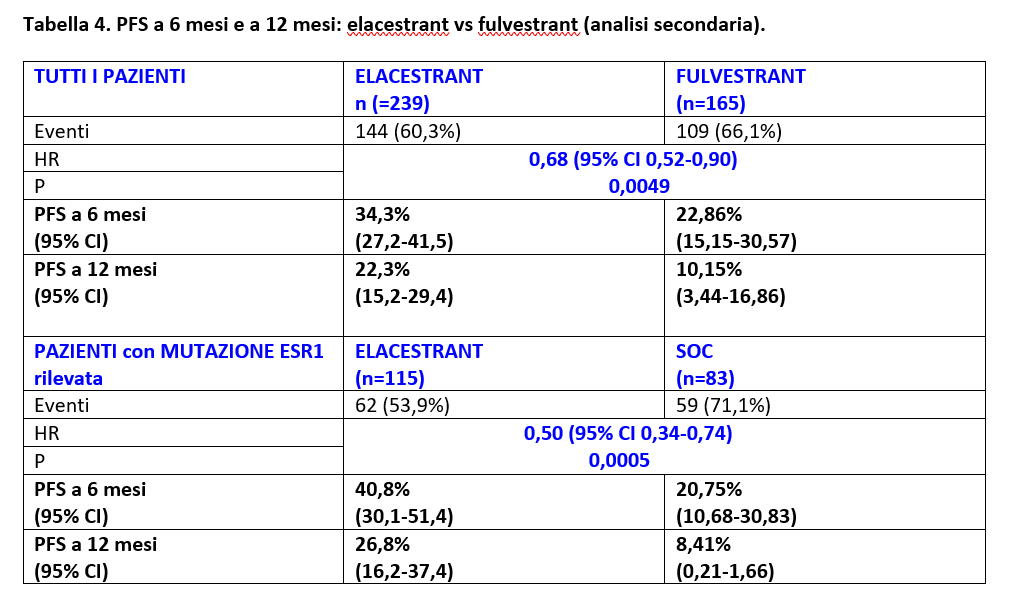
Ad una analisi secondaria, l’efficacia di Elacestrant in PFS è stata mantenuta quando elacestrant è stato confrontato con il sottogruppo Fulvestrant (Tabella 4).
La PFS a 6 mesi e a 12 mesi è risultata essere statisticamente superiore con Elacestrant sia in tutti i pazienti che nei pazienti con mutazione ESR1 rilevata dal test, con un vantaggio clinicamente rilevante (Tabella 4).
Gli effetti collaterali più frequenti osservati nel gruppo elacestrant vs SOC sono stati:
-nausea (35% vs 18%);
-fatigue (19% vs 18%);
– vomito (19% vs 8,3%);
-riduzione dell’appetito (14,8% vs 9,2%);
-artralgia (14,3% vs 16,2%).
I più comuni effetti collaterali di grado 3/4 osservati sono stati:
-nel gruppo elacestrant ![]() Nausea (2,5%), dolore vertebrale (2,5%), aumento ALT (2,1%);
Nausea (2,5%), dolore vertebrale (2,5%), aumento ALT (2,1%);
-nel gruppo SOC ![]() Nausea (0,9%), fatigue (0,9%), diarrea (0,9%), aumento AST (0,9%).
Nausea (0,9%), fatigue (0,9%), diarrea (0,9%), aumento AST (0,9%).
Gli eventi avversi hanno determinato l’interruzione del trattamento in 15 pazienti (6,3%) del gruppo elacestrant e in 10 pazienti (4,4%) del gruppo SOC. Non sono stati riportati decessi correlati al trattamento in entrambi i gruppi.
In una analisi di sottogruppo presentata a San Antonio Breast Cancer Symposium 2022, è stato evidenziato un vantaggio in PFS con elacestrant superiore nei pazienti che avevano avuto una più lungo controllo di malattia con precedente terapia comprendente inibitori di CDK4/6 (Bardia a et al, 2022).
COMMENTO
Elacestrant è disponibile in Italia dal marzo 2024 nell’ambito di un EXPANDED ACCESS PROGRAM nelle pazienti con carcinoma mammario metastatico HR+/HER2-negativo con mutazione di ESR1 in progressione ad almeno una e non più di due linee di terapia endocrina comprendente inibitori di CDK/4-6. La valutazione della mutazione di ERS1 deve essere eseguita al momento della progressione, su ctDNA con biopsia liquida.
Nel 2023 ASCO ha pubblicato un aggiornamento delle Linee Guida (Burnstein HJ et al, JCO 2023) in cui il Panel di Esperti raccomanda di effettuare un test di routine per la valutazione di una mutazione di ESR1 nelle pazienti con carcinoma mammario ER-positivo/HER2-negativo al momento della ripresa/progressione durante endocrinoterapia (con o senza inibitore di CDK 4/&). Il test dovrebbe essere effettuato al momento della progressione poiché la mutazione di ERS1 si sviluppa in risposta alla pressione di selezione durante il trattamento e non è rilevabile al momento della diagnosi nel tumore primitivo. E’ preferibile eseguire il test (certificato) su ctDNA (DNA tumorale circolante) in campioni di sangue (biopsia liquida) perchè è maggiore la sensibilità (rispetto al test effettuato su tessuto).
Bibliografia
Bardia A, Kaklamani V, Wilks S, Weise A, Richards D, Harb W, Osborne C, Wesolowski R, Karuturi M, Conkling P, Bagley RG, Wang Y, Conlan MG, Kabos P.
Phase I Study of Elacestrant (RAD1901), a Novel Selective Estrogen Receptor Degrader, in ER-Positive, HER2-Negative Advanced Breast Cancer.
J Clin Oncol. 2021 Apr 20;39(12):1360-1370. doi: 10.1200/JCO.20.02272.
Bardia A, Aftimos P, Bihani T, Anderson-Villaluz AT, Jung J, Conlan MC, Kaklamani VG.
EMERALD: Phase III trial of elacestrant (RAD1901) vs endocrine therapy for previously treated ER+ advanced breast cancer. Future Oncology 2019 15:28, 3209-3218
GS3-01 EMERALD phase 3 trial of elacestrant versus standard of care endocrine therapy in patients with ER+/HER2- metastatic breast cancer: Updated results by duration of prior CDK4/6i in metastatic setting
Bardia A, et al. SABCS 2022
Wolff AC, Hammond MEH, Allison KH, Harvey BE, McShane LM, Dowsett M. HER2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update Summary. JCO Oncol Pract 2018; 14:437-441.
Burstein HJ, DeMichele A, Somerfield MR, Henry NL; Biomarker Testing and Endocrine and Targeted Therapy in Metastatic Breast Cancer Expert Panels. Testing for ESR1 Mutations to Guide Therapy for Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Metastatic Breast Cancer: ASCO Guideline Rapid Recommendation Update. J Clin Oncol. 2023 Jun 20;41(18):3423-3425.
Link all’abstract

