PERIOPERATIVE DURVALUMAB FOR RESECTABLE NON-SMALL-CELL LUNG CANCER
J.V. Heymach, D. Harpole, T. Mitsudomi, J.M. Taube, G. Galffy, M. Hochmair, T. Winder, R. Zukov, G. Garbaos, S. Gao, H. Kuroda, G. Ostoros, T.V. Tran, J. You, K.-Y. Lee, L. Antonuzzo, Z. Papai-Szekely, H. Akamatsu, B. Biswas, A. Spira, J. Crawford, H.T. Le, M. Aperghis, G.J. Doherty, H. Mann, T.M. Fouad, and M. Reck, for the AEGEAN Investigators*
N Engl J Med 2023;389:1672-84. DOI: 10.1056/NEJMoa2304875
**** In Italia, il durvalumab perioperatorio è disponibile da maggio 2024 all’interno di un programma EAP per i pazienti con NSCLC resecabile con criteri di accesso che sono sovrapponibili ai criteri di eleggibilità dello studio AEGEAN****
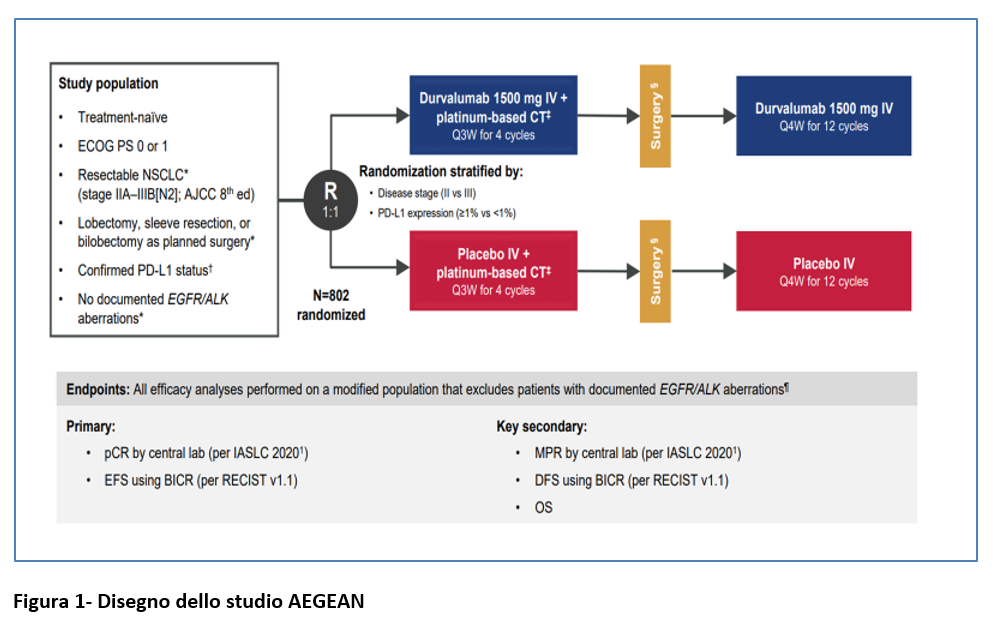
Lo studio AEGEAN (studio di fase 3, doppio cieco, placebo-controllato) ha valutato l’uso di durvalumab (anticorpo anti-PD-L1) somministrato nel setting peri-operatorio ( in neo-adiuvante e in adiuvante) in combinazione con chemioterapia neo-adiuvante in pazienti con NSCLC operabile.
METODI
I pazienti eleggibili avevano una diagnosi istologicamente o citologicamente accertata di NSCLC non trattato, resecabile [ stadio IIA-IIIB (N2)] secondo l’8a edizione AJCC 2018, con stadiazione patologica dei linfonodi mediastinici a discrezione dell’investigatore.
Doveva essere documentato lo stato di PD-L1 valutato in un laboratorio centralizzato con test immunoistochimico Ventana SP263.
Durante l’arruolamento il protocollo è stato emendato per escludere pazienti con tumori T4 per qualsiasi altra ragione all’infuori delle dimensioni ( T>7 cm), pazienti che avrebbero dovuto essere sottoposti a pneumectomia, pazienti con documentata presenza di mutazione EGFR o traslocazione ALK.
I pazienti sono stati arruolati (R 1:1) a ricevere 4 cicli di chemioterapia contenete platino + durvalumab a dose fissa (1.500 mg/iv) oppure placebo-ogni 3 settimane-, con successiva chirurgia.
Dopo la chirurgia, i pazienti hanno continuato a ricevere durvalumab o placebo/ogni 4 settimane fino a 12 cicli. La randomizzazione prevedeva una stratificazione in base allo stadio (II o III) e all’espressione di PD-L1 (<1% oppure ≥1%) (Figura 1).
Il regime chemioterapico veniva determinato in base alle caratteristiche istologiche (Figura 1). L’inizio del trattamento adiuvante veniva previsto al più presto dopo la chirurgia (entro 10 settimane al massimo dopo la chirurgia) oppure dopo 3 settimane dalla fine della radioterapia post-operatoria (permessa se indicata). Se indicata, la radioterapia doveva iniziare entro 8 settimane dopo la chirurgia. Per essere elegibile a ricevere terapia adiuvante (durvalumab o placebo), i pazienti dovevano avere margini chirurgici R0 o R1 e dovevano aver fatto una TC postchirurgica.
Gli endpoints primari erano l’Event-Free Survival (valutata da una commissione centrale indipendente) e la risposta completa patologica (con revisione centralizzata).
L’Event-Free Survival è stata definita come il tempo intercorso dalla randomizzazione alla comparsa di:
-progressione di malattia che preludeva la chirurgia;
-progressione di malattia evidenziata alla chirurgia che impediva completamento della chirurgia;
-ripresa locale o a distanza (sec. RECIST);
-morte per qualsiasi causa.
La risposta completa patologica è stata definita come assenza di cellule tumorali vitali nel tumore polmonare asportato e in tutti i linfonodi regionali campionati. La risposta patologica maggiore è stata definita come la presenza del 10% o meno di cellule tumorali vitali nel tumore polmonare primitivo.
L’analisi statistica è stata fatta su 740 degli 802 pazienti arruolati, escludendo i 62 pazienti con alterazione di EGFR/ALK arruolati prima dell’emendamento del protocollo. I 740 pazienti costituiscono la mITT population (=modified Intention-To-Treat population).
*Il protocollo è stato modificato mentre l’arruolamento era in corso per escludere (1) i pazienti con tumori classificati come T4 per qualsiasi motivo diverso dalle dimensioni; (2) i pazienti con chirurgia che prevedeva una pneumonectomia; e (3) i pazienti con documentate aberrazioni di EGFR/ALK.
†Test IHC Ventana SP263.
‡ Scelta del regime di CT determinata dall’istologia e a discrezione dello sperimentatore. Per i carcinomi non squamosi: cisplatino + pemetrexed o carboplatino + pemetrexed. Per i carcinomi sqaumosi: carboplatino + paclitaxel oppure cisplatino + gemcitabina (o carboplatino + gemcitabina per i pazienti con comorbidità o non in grado di tollerare il cisplatino a giudizio dello sperimentatore).
- La radioterapia post-operatoria (PORT) è stata consentita laddove indicato dalle linee guida locali.
Tutte le analisi di efficacia riportate in questa presentazione sono state eseguite sulla popolazione mITT, che comprende tutti i pazienti randomizzati che non presentavano aberrazioni EGFR/ALK documentate.
AJCC, American Joint Committee on Cancer- Ottava edizione del 2018;
NOTE: BICR, blinded independent central review; DFS, sopravvivenza libera da malattia; EFS, sopravvivenza libera da eventi; mITT, modified intent-to-treat; MPR, major pathologic response; pCR, pathologic complete response.
RISULTATI
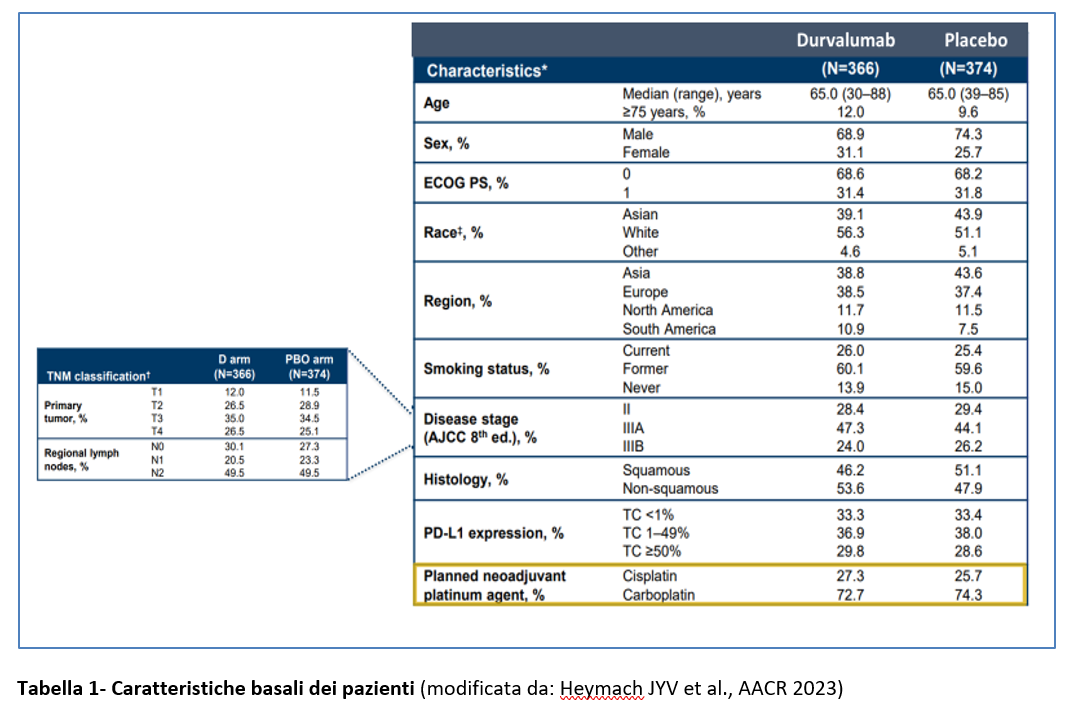
Da gennaio 2019 ad aprile 2022 sono stati arruolati 1480 pazienti in 28 paesi: di questi, sono stati randomizzati 802. Nella Tabella 1 sono riportate le caratteristiche basali dei 740 pazienti che costituiscono la popolazione mITT (=modified intention-to-treat population), cioè la popolazione arruolata con l’esclusione di 62 pazienti con mutazioni di EGFR o traslocazione ALK).Oltre il 70% dei pazienti arruolati aveva uno stadio III di malattia e circa la metà aveva una malattia N2. Circa il 50% dei pazienti aveva una sitologia squamosa e circa il 50% aveva una istologia non squamosa (Tabella1).
Globalmente il 33,4% dei pazienti aveva una espressione di PD-L1 minore dell’1% e il carboplatino è stato utilizzato in neoadiuvante nel 73,5% dei pazienti (vs il 26,5% in cui è stato usato cisplatino).
Ad un follow up di 11,7 mesi (data cutoff:10 novembre 2022), circa l’85% dei pazienti aveva completato 4 cicli di chemioterapia neoadiuvante e oltre il 60% aveva iniziato a ricevere durvalumab o placebo adiuvante.
Solo il 6,4% dei pazienti aveva ricevuto radioterapia post-operatoria.
Globalmente, il 24% dei pazienti del gruppo durvalumab e il 21% del gruppo placebo aveva completato 12 cicli di terapia adiuvante alla data del cutoff; il 18,6% e il 18,7% dei due gruppi aveva interrotto terapia (nella maggior parte dei casi per progressione di malattia); il 23,2% del gruppo durvalumab e il 23,5% del gruppo placebo stava ancora ricevendo durvalumab oppure placebo adiuvante.
CHIRURGIA
In totale, il 77,6% dei pazienti del gruppo durvalumab e il 76,7% del gruppo placebo hanno completato la chirurgia toracica: il 94,7% del gruppo durvalumab aveva avuto una resezione R0 vs 91,3% del gruppo placebo; 4,2% dei pazienti del gruppo durvalumab ha avuto una resezione R1 vs 7,7% del gruppo placebo.
EVENT-FREE SURVIVAL
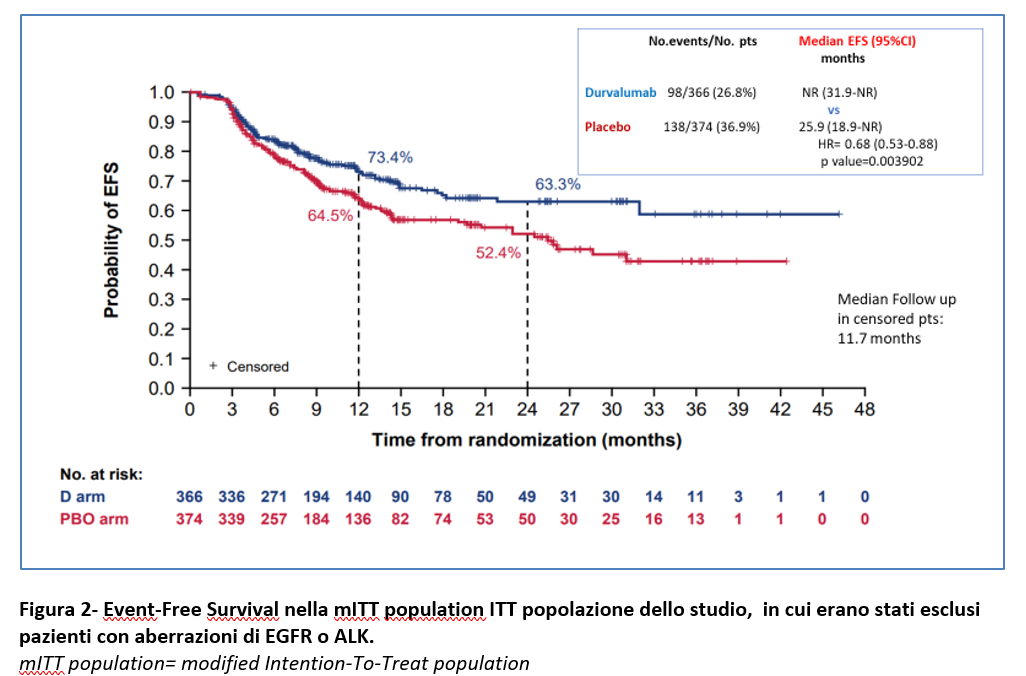
Ad un follow-up mediano di 11,7 mesi, alla prima analisi ad interim dell’EFS (con una maturità dei dati del 31,9%), l’EFS nella popolazione mITT (=modified intention-to-treat population) non è stata raggiunta nel braccio del regime basato su durvalumab rispetto ai 25,9 mesi del braccio della sola chemioterapia. + placebo con HR =0,68 (95% CI 0,53-0,88; p=0,004). Ciò significa che i pazienti nel braccio durvalumab hanno mostrato una riduzione del 32% del rischio di progressione della malattia che preclude l’intervento chirurgico definitivo, di recidiva della malattia o di morte rispetto a quelli nel braccio della sola chemioterapia+ placebo (Figura 2).
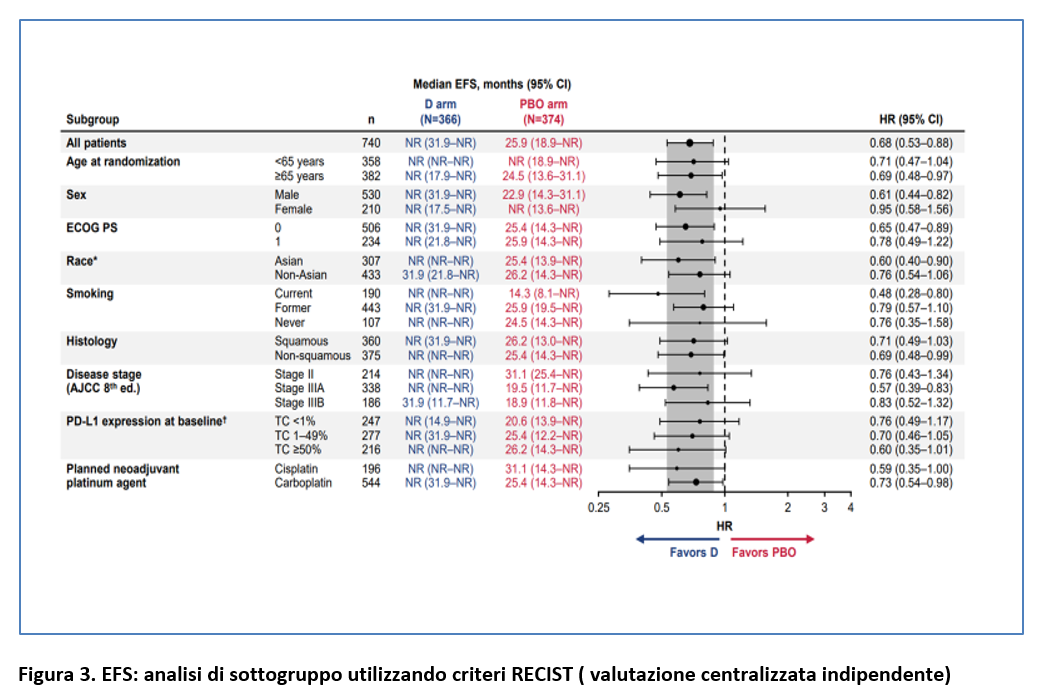
L’EFS a 12 mesi è stata del 73,4% nel gruppo durvalumab vs 64,5% nel gruppo placebo e l’EFS a 24 mesi è stata del 63,3% vs 52,4 (Figura 2). Il beneficio in EFS con l’aggiunta di durvalumab è stato mantenuto nella maggior parte dei sottogruppi prespecificati (Figura 3).
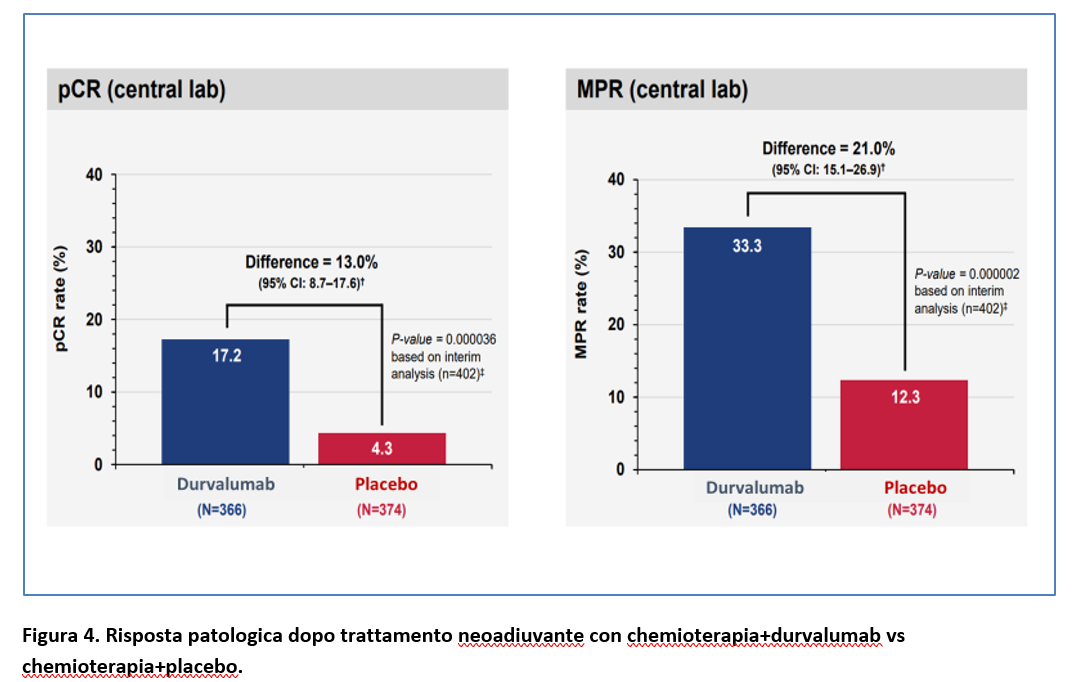
RISPOSTA COMPLETA PATOLOGICA
Il tasso di risposta completa patologica è stato più alto nel gruppo durvalumab+chemioterapia vs il gruppo chemioterapia+placebo (17,2% vs 4,3%; p<0,001) così come il tasso di risposta patologica maggiore (33,3% vs 12,3%: p<0,001) (Figura 4).
Il beneficio in EFS e pCR con durvalumab è stato osservato indipendentemente dallo stadio di malattia e dell’espressione di PD-L1.
TOLLERABILITÀ
Eventi avversi di grado 3-4 sono stati registrati nel 42,4% dei pazienti del gruppo Durvalumab e nel 43,2% dei pazienti del gruppo Placebo.
CONCLUSIONI
Nei pazienti con NSCLC resecabile, il durvalumab perioperatorio (durvalumab+ chemioterapia neoadiuvante seguito da durvalumab adiuvante, dopo la chirurgia) ha determinato un vantaggio statisticamente significativo in EFS e tasso di pCR rispetto alla sola chemioterapia neoadiuvante, con un profilo di tossicità in linea con quello riportato per i singoli farmaci antitumorali.
COMMENTO
In Italia, il durvalumab perioperatorio è disponibile da maggio 2024 all’interno di un programma EAP per i pazienti con NSCLC resecabile con criteri di accesso che sono sovrapponibili ai criteri di eleggibilità dello studio AEGEAN.
BIBLIOGRAFIA
John V. Heymach et al. AEGEAN: A Phase 3 Trial of Neoadjuvant Durvalumab + Chemotherapy Followed by Adjuvant Durvalumab in Patients with Resectable NSCLC. AACR 2023
Mitsudomi T et al. Surgical outcomes with neoadjuvant durvalumab+chemotherapy followed by adjuvant durvalumab in resectable NSCLC ( AEGEAN). 2023 World Conference on Lung Cancer.
J Thorac Oncol 2023;18(11) Suppl S71-S72 (Abstract OA12.05)
LINK all’abstract
https://pubmed.ncbi.nlm.nih.gov/37870974/


