
FIRST-LINE MOBOCERTINIB VERSUS PLATINUM-BASED CHEMOTHERAPY IN PATIENTS WITH EGFR EXON 20 INSERTION-POSITIVE METASTATIC NON-SMALL CELL LUNG CANCER IN THE PHASE III EXCLAIM-2 TRIAL.
Pasi A. J¨anne, Bin-Chao Wang, Byoung Chul Cho, Jun Zhao, Juan Li, Maximilian Hochmair, Solange Peters, Benjamin Besse, Nick Pavlakis, Joel W. Neal, Terufumi Kato, Yi-Long Wu, Danny Nguyen, Junjing Lin, Jianchang Lin, Florin Vranceanu, Annette Szumski, Huamao M. Lin, Robert J. Fram, and Tony S.K. Mok.
J Clin Oncol. 2025 Jan 29:JCO2401269. doi: 10.1200/JCO-24-01269.
Free article
Link all’abstract
https://pubmed.ncbi.nlm.nih.gov/39879577/
Mobocertinib ad oggi non è rimborsato in Italia.
Le mutazioni inserzionali dell’esone 20 (ex20ins) dell’Epidermal growth factor receptor (EGFR) rappresentano il 6%-12% di tutti i non–small cell lung cancer (NSCLC) mutati (1,2). In questi pazienti gli inibitori tirosino-chinasici (TKIs) di EGFR di prima e seconda generazione hanno tassi di risposta oggettiva (ORR) del 10% e sopravvivenza libera da progressione di 1-3 mesi (2-5). La chemioterapia platino-basata rappresenta il trattamento di scelta in questa sottopopolazione di NSCLC sebbene con risultati poco soddisfacenti: una ORR di 24,6%-47,0%, una PFS mediana di 5,6-7,1 mesi e una sopravvivenza globale di 19,6-24,4 mesi (6-8).
Mobocertinib è un TKI contro le mutazioni di EGFR ex20ins, primo della sua classe. In uno studio di fase 1/2 mobocertinib ha mostrato in pazienti con NSCLC localmente avanzato o metastatico, con mutazione EGFR ex20ins, una ORR, definita da un comitato di revisione indipendente (IRC), del 28%, una durata della risposta mediana (DoR) di 15.8 mesi e una PFS mediana di 7.3 mesi (9). A seguito di tali dati Mobocertinib ha ricevuto una approvazione accelerata da parte della US Food and Drug Administration (FDA) nel settembre 2021 per i pazienti con NSCLC metastatico o localmente avanzato con mutazione a EGFR ex20ins e in progressione a trattamento platino-basato (18-20).
La presente pubblicazione riporta i dati dello studio confirmatorio di Fase III EXCLAIM-2 che ha confrontato efficacia e sicurezza di mobocertinib rispetto alla chemioterapia platino-basata in prima linea per i pazienti con NSCLC avanzato con EGFR ex20ins.
METODI
Per lo studio erano candidabili pazienti con NSCLC stadio IIIB/C (non candidabili per chirurgia o chemio-radioterapia definitiva) o con stadio IV, con mutazione EGFR ex20ins, non pretrattati.
Nello studio di fase III, randomizzato, in aperto, multicentrico EXCLAIM-2, i pazienti venivano assegnati al trattamento sperimentale o allo standard con randomizzazione 1:1, stratificati per la presenza o meno di metastasi cerebrali alla diagnosi e per la razza (asiatica/ non asiatica) (Figura 1). Il cross over era consentito dopo conferma centralizzata di progressione.
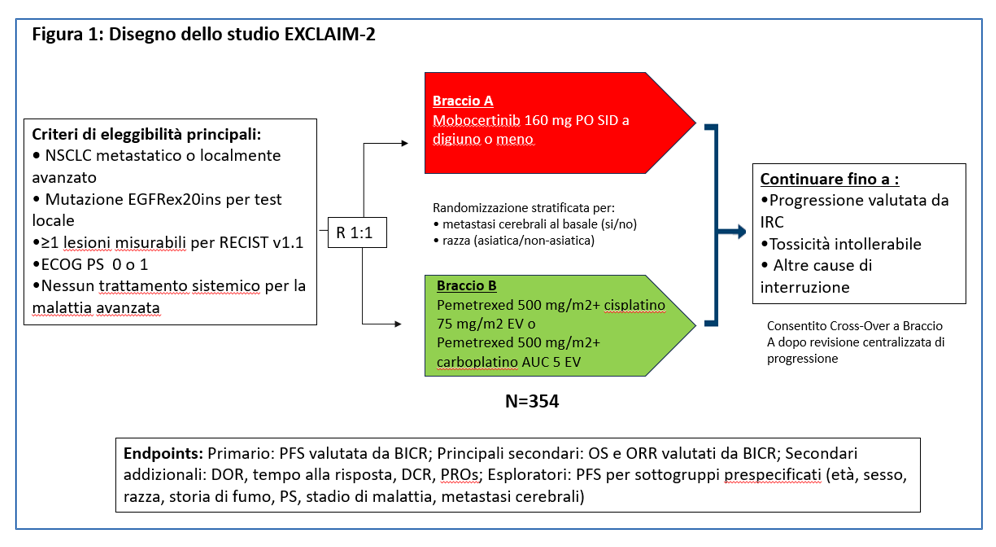
La tipologia di platino utilizzabile (cisplatinio o carboplatino) da associarsi a pemetrexed era lasciata alla scelta dell’investigatore.
L’end point primario dello studio era la PFS valutata da un blinded independent central review (BICR); secondari erano la OS e la ORR valutate da BICR, la DORil tempo alla risposta, il tasso di controllo della malattia (DCR) e la qualità di vita dei pazienti valutata tramite Patients Reported Oucomes (PROs). Obbiettivo esploratorio poi era la PFS valutata in diversi sottogruppi prepianificati (età, sesso, razza, storia di fumo, PS, stadio della malattia e presenza di metastasi cerebrali presenti al basale).
RISULTATI
Sono stati arruolati complessivamente 354 pazienti di cui 179 sono stati randomizzati a ricevere mocertinib e 174 chemioterapia platino-basata (144 hanno ricevuto carboplatino e 19 cisplatino). Il follow up mediano è stato di 13.1 mesi per il gruppo con Mobocertinib e di 13.8 mesi per quello con chemioterapia.
Le caratteristiche generali erano ben bilanciate tra i due gruppi (Tabella 1 e 2).
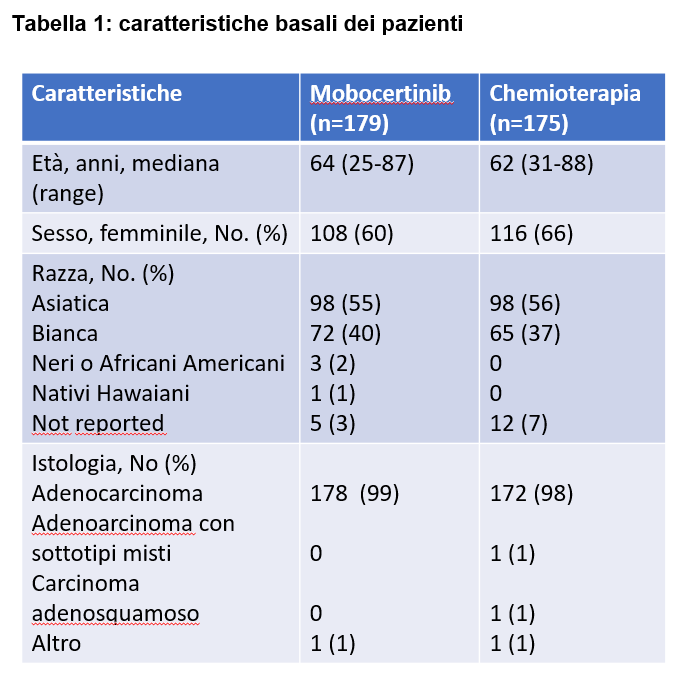
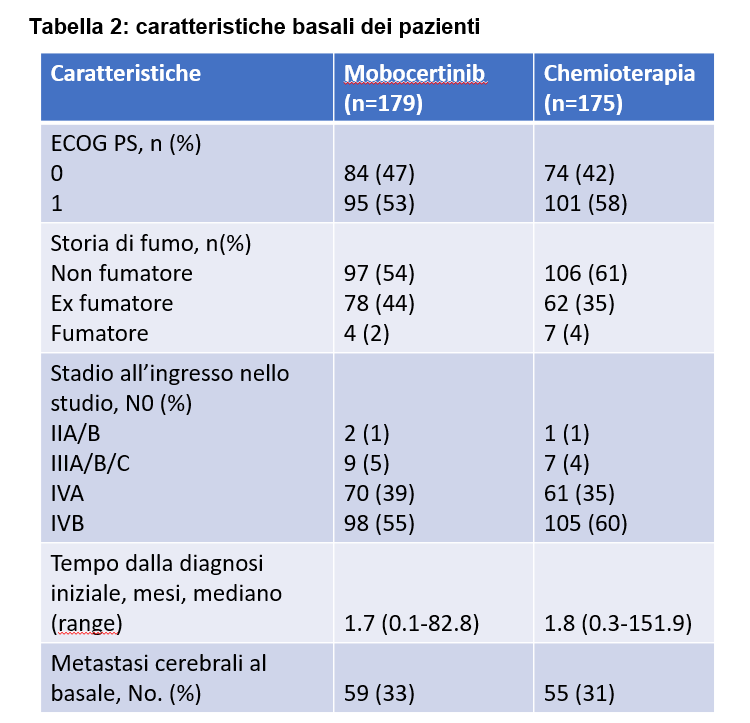
Circa il 33% dei pazienti trattati con mobocertinib e il 31% di quelli in chemioterapia presentava metastasi cerebrali alla diagnosi.
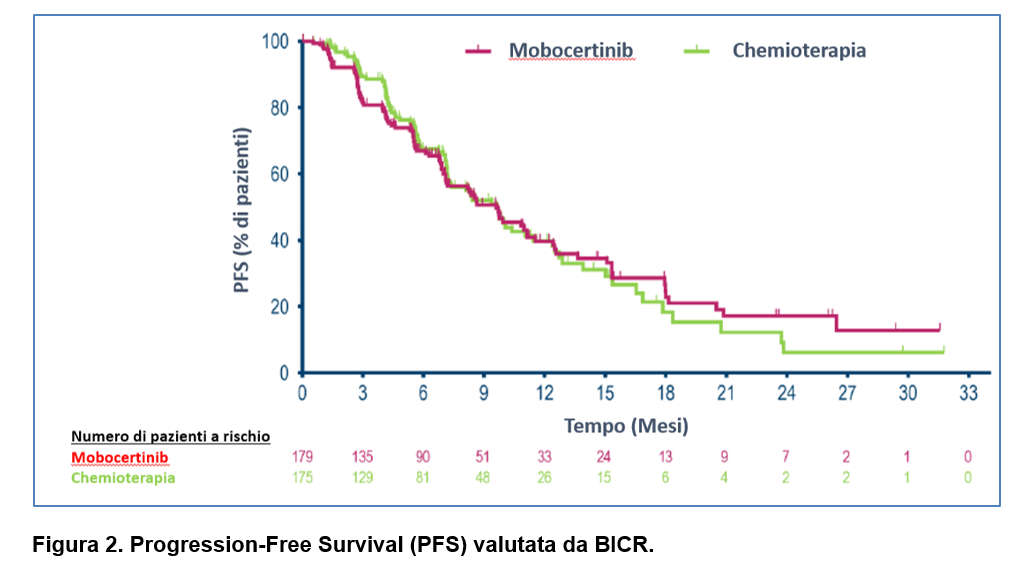
La PFS mediana valutata da BICR è stata uguale nei due bracci di trattamento (9.6 mesi vs 9.6 mesi; HR = 1.048; 95 % CI: 0.77–1.39, log-rank P =0.803) (Figura 2). Dati tali risultati lo studio non ha superato l’analisi di futilità e pertanto è stato discontinuato. Non si sono evidenziati specifici vantaggi nell’analisi per sottogruppo prepianificata. Sessanta tre pazienti hanno eseguito cross-over al trattamento sperimentale con una PFS valutata da BICR di 6.8 mesi con mobocertinib di seconda linea.
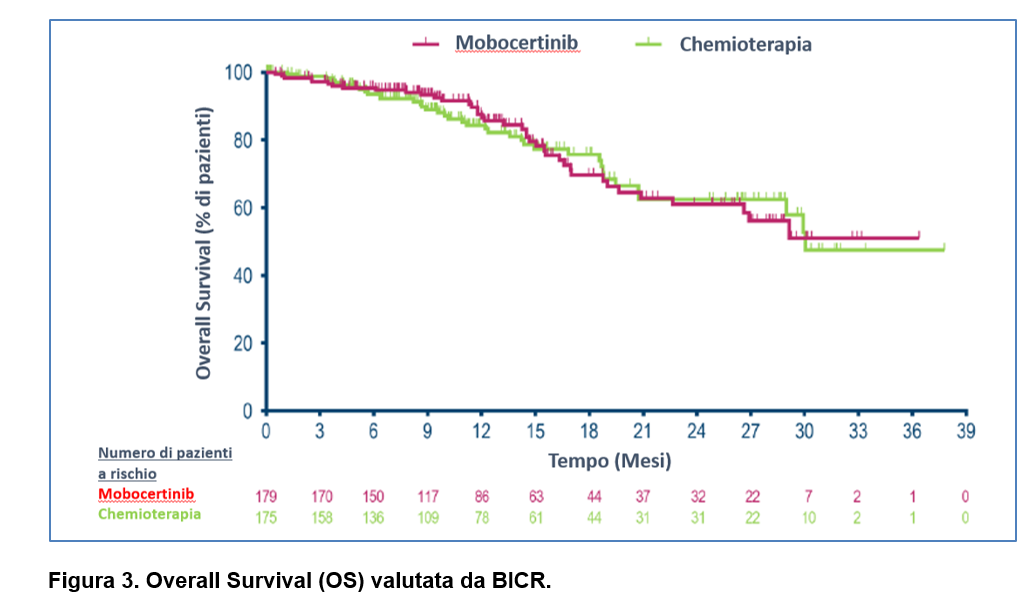
La OS mediana è stata non estimabile nel braccio sperimentale e di 30 mesi nel braccio di controllo (HR = 0.98, 95 % CI: 0.62–1.54) (Figura 3). I tassi di OS a 2 e 3 anni sono stati nel braccio con mobocertinib del 61% e del 51% e nel braccio con chemioterapia del 62% e del 47%, rispettivamente.
Nel braccio sperimentale la ORR è stata del 32 % mentre in quello di controllo è stata del 30% nella valutazione di BICR. Il DCR è stato dell’87% con mobocertinib e dell’80% con chemioterapia nella valutazione BICR. Il tempo mediano alla risposta secondo BICR è stato di 1.5 mesi con mobocertinib e di 2.8 mesi con la chemioterapia; la DOR mediana è stata di 12 mesi nel braccio sperimentale e di 8.4 mesi in quello con chemioterapia.
Nell’ambito dei Patients Reported Outcomes, il tempo mediano al deterioramento dei sintomi valutato con il sistema di valutazione dei sintomi (tosse, dispnea, dolore toracico) per il tumore del polmone EORTC QLQ-LC13 è stato di 9.4 mesi e 5 mesi per mobocertinib e per la chemioterapia, rispettivamente. Il tasso di eventi è stato del 46% e del 56% con mobocertinib e con chemioterapia, rispettivamente (HR, 0.68 [95% CI, 0.50 to 0.93]).
SAFETY
Gli eventi avversi più comuni, legati al trattamento (TEAEs) di qualunque grado con mobocertinib sono stati diarrea (96%), paronichia (47%), riduzione dell’appetito (43%) e stomatite (40%); con chemioterapia sono stati stipsi (48%), nausea (47%), e anemia (42%). I più comuni TEAEs di grado 3 sono stati diarrea (20%), incremento delle lipasi (6%), e anemia (6%) con mobocertinib and anemia (10%), neutropenia (9%), e riduzione della conta dei neutrofili (7%) con chemotherapia. Modificazioni della dose a causa di TEAEs sono occorsi più frequentemente con mobocertinib (77%) che con chemoterapia (63%). I TEAEs che hanno portato a interruzione definitiva del trattamento sono stati del 18% con mobocertinib e del 20% con chemioterapia. L’HR per la PFS tra i due bracci di trattamento non sembra essere stato influenzato dalle riduzioni di dose per i TEAEs. Nel braccio di trattamento con mobocertinib il 24% dei pazienti ha avuto una riduzione di dose (indipendentemente dalla causa) e il 26% ha avuto più di due riduzioni di dose.
CONCLUSIONE
Lo studio EXCLAIM-2 non ha raggiunto il suo end point primario. L’efficacia di mobocertinib non si è dimostrata superiore alla chemioterapia platino-basata nella prima linea di trattamento per i pazienti con NSCLC localmente avanzato o metastatico con mutazione EGFR ex20ins.
COMMENTO a cura di Angelo Delmonte – IRCCS Istituto Romagnolo per lo Studio dei Tumori “Dino Amadori” (IRST), Meldola (FC)
I tumori polmonari non microcitomi con mutazione inserzionale dell’esone 20 del gene EGFR rappresentano una popolazione di tumori oncogene addicted non responsivi agli inibitori di tirosin-chinasi (TKI) anti-EGFR diretti contro le mutazioni attivanti più frequenti. Tale gruppo manifesta un forte medical need poichè di fatto il trattamento di scelta è rappresentato dalla chemioterapia con risultati poco soddisfacenti, come già riportato. Peraltro poi l’approccio immunoterapico è un’opzione con risultati limitati e da riservarsi in casi selezionati al termine delle opzioni terapeutiche di maggiore attività (13). E’ quindi indubbio che per i pazienti affetti da tale patologia vi sia una forte urgenza di opzioni terapeutiche.
Il presente studio ha confrontato uno dei primi TKI sviluppati in tale ambito, mobocertinib, rispetto allo standard di trattamento che è la chemioterapia platino basata. I risultati ottenuti non confermano in prima linea di malattia la superiorità del farmaco sperimentale e pertanto, pur essendo approvato in USA, mobocertinib ad oggi non risulta disponibile in Italia neppure in seconda linea. Nonostante tale insuccesso, sono però in via di sviluppo alcuni TKI con dati di Fase 2 di particolare rilevanza: sunvozertinib, firmonertinib e zipalertinib. Per quanto riguarda quest’ultimo, è di gennaio 2025 una press release che ha confermato il raggiungimento dell’obbiettivo primario (ORR) dello studio di Fase 1/2 Rezilient1 (14); per sunvozertinib e firmonertinib i dati degli studi Fase 2 appaiono altresì promettenti (15). Ad oggi quindi si attendono gli esiti dei trial clinici di Fase 3 di prima linea che sono presenti sul territorio nazionale e che stanno arruolando attivamente.
In attesa però dei dati relativi ai citati TKI, il panorama terapeutico di questa patologia ha già avuto un significativo miglioramento con l’introduzione, al fallimento della terapia platino basata, dell’anticorpo monoclonale bispecifico amivantamab. Nello studio infatti di Fase 1 CHRYSALIS amivantamab ha mostrato una ORR del 40%, con una media DoR di 11.1 mesi, una PFS di 8.3 mesi e una media OS di 22.8 mesi (16). Il farmaco è gravato da reazioni allergiche infusive (che con la futura introduzione della formulazione sottocutanea dovrebbero essere limitate, come mostrato nello studio PALOMA (17)), rash cutaneo e paronichia, tutte complessivamente gestibili dopo un’adeguata curva di apprendimento gestionale e l’applicazione di strategie terapeutiche di mitigazione (18). Tali dati hanno quindi portato alla rimborsabilità di amivantamab dalla seconda linea di trattamento.
L’utilizzo di amivantamab, però, è destinato ben presto a modificarsi ulteriormente, grazie ai dati dello studio di Fase 3 PAPILLON che ha valutato l’attività della chemioterapia platino basata da sola o in combinazione con amivantamab. Il trattamento di combinazione ha mostrato una PFS di 11.1 mesi rispetto ai 6.7 mesi del braccio di controllo con un HR di 0.395 (0.30, 0.53; <0.0001) e un tasso di pazienti liberi da progressione a 18 mesi del 31% contro il 3%, raggiungendo così il suo obbiettivo primario. L’analisi poi per sottogruppi ha poi mostrato un vantaggio del braccio sperimentale in tutti i setting analizzati (19). Ad oggi siamo in attesa dell’approvazione AIFA per la rimborsabilità.
Lo scenario terapeutico quindi per i NSCLC con mutazione inserzionale dell’esone 20 risulta in graduale e costante evoluzione confermando, ancora una volta come, nella patologie oncogene addicted, le maggiori chance terapeutiche si possano ottenere tramite farmaci specifici per il bersaglio molecolare. E’ realistico quindi che ben presto per questi pazienti vi saranno molteplici opzioni terapeutiche e che occorrerà definire le strategie di sequenza più efficaci.
Attualmente, a maggio 2025, mobocertinib non è né approvato né rimborsato in Italia.
BIBLIOGRAFIA
- Kobayashi Y, Mitsudomi T: Not all epidermal growth factor receptor mutations in lung cancer are created equal: Perspectives for individualized treatment strategy. Cancer Sci 107:1179-1186, 2016
- Riess JW, Gandara DR, Frampton GM, et al: Diverse EGFR exon 20 insertions and co-occurring molecular alterations identified by comprehensive genomic profiling of NSCLC. J Thorac Oncol 13: 1560-1568, 2018
- O’Kane GM, Bradbury PA, Feld R, et al: Uncommon EGFR mutations in advanced non-small cell lung cancer. Lung Cancer 109:137-144, 2017
- Lin HM, Yin Y, Crossland V, et al: EGFR testing patterns and detection of EGFR exon 20 insertions in the United States. JTO Clin Res Rep 3:100285, 2022
- Lau SC, Chooback N, Ho C, et al: Outcome differences between first- and second-generation EGFR inhibitors in advanced EGFR mutated NSCLC in a large population-based cohort. Clin Lung Cancer 20:e576-e583, 2019
- Shah MP, Aredo JV, Padda SK, et al: EGFR exon 20 insertion NSCLC and response to platinum-based chemotherapy. Clin Lung Cancer 23:e148-e153, 2022
- Kwon CS, Lin HM, Crossland V, et al: Non-small cell lung cancer with EGFR exon 20 insertion mutation: A systematic literature review and meta-analysis of patient outcomes. Curr Med Res Opin 38: 1341-1350, 2022
- Zhou C, Tang KJ, Cho BC, et al: Amivantamab plus chemotherapy in NSCLC with EGFR exon 20 insertions. N Engl J Med 389:2039-2051, 2023
- Ramalingam SS, Zhou C, Kim TM, et al: Phase 1/2 study of mobocertinib in EGFR exon 20 insertion (ex20ins)1 metastatic NSCLC (mNSCLC): Updated results from platinum-pretreated patients (PPP) [poster 988P]. Presented at Annual Congress of the European Society for Medical Oncology, Paris, France, September 9-13, 2022
- Duke ES, Stapleford L, Drezner N, et al: FDA approval summary: Mobocertinib for metastatic non-small cell lung cancer with EGFR exon 20 insertion mutations. Clin Cancer Res 29:508-512, 2023
- Exkivity [package insert]. Takeda Pharmaceuticals America, Inc, Lexington, MA, 2023
- FDA grants accelerated approval to mobocertinib for metastatic non-small cell lung cancer with EGFR exon 20 insertion mutations [press release]. U.S. Food & Drug Administration, 2021. https://ecancer.org/en/news/20939-fda-grants-accelerated-approval-to-mobocertinib-for-metastatic-non-small-cell-lung-cancer-with-egfr-exon-20-insertion-mutations
- Mazieres J, Drilon A, Lusque A et al. Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: results from the IMMUNOTARGET registry. Ann Oncol. 2019 Aug 1;30(8):1321-1328.
- https://www.prnewswire.com/news-releases/taiho-pharmaceutical-taiho-oncology-and-cullinan-therapeutics-announce-primary-endpoint-met-in-phase-2b-trial-of-zipalertinib-in-patients-with-non-small-cell-lung-cancer-harboring-egfr-exon-20-insertion-mutations-who-have-receiv-302362492.html
- Christopoulos P. A new era for EGFR exon20 targeting in non-small cell lung cancer. Chin Clin Oncol. 2025 Feb;14(1):14.
- Park K, Haura EB, Leighl NB et al. Amivantamab in EGFR Exon 20 Insertion-Mutated Non-Small-Cell Lung Cancer Progressing on Platinum Chemotherapy: Initial Results From the CHRYSALIS Phase I Study. J Clin Oncol. 2021 Oct 20;39(30):3391-3402.
- Leighl NB, Akamatsu H, Lim SM et al. Subcutaneous Versus Intravenous Amivantamab, Both in combination With Lazertinib, in Refractory Epidermal Growth Factor Receptor-Mutated Non-Small Cell Lung Cancer: Primary Results From the Phase III PALOMA-3 Study. J Clin Oncol. 2024 Oct 20;42(30):3593-3605.
- Brazel D, Smith J, Ou SI, Nagasaka M. The User’s Guide to Amivantamab. Target Oncol. 2025 Mar;20(2):235-245.
- Zhou C, Tang KJ, Cho BC et al. Amivantamab plus Chemotherapy in NSCLC with EGFR Exon 20 Insertions. N Engl J Med. 2023 Nov 30;389(22):2039-2051.


