
OlympiA: A PHASE 3, MULTICENTER, RANDOMIZED, PLACEBO-CONTROLLED TRIAL OF ADJUVANT OLAPARIB AFTER (NEO)ADJUVANT CHEMOTHERAPY IN PATIENTS WITH GERMLINE BRCA1 AND/OR BRCA2 PATHOGENIC VARIANTS AND HIGH RISK HER2-NEGATIVE PRIMARY BREAST CANCER: LONGER TERM FOLLOW-UP.
Garber J. A. et al.
Presented at: San Antonio Breast Cancer Conference; December 10-13, 2024; San Antonio, TX. Abstract # GS1-09
In Italia olaparib adiuvante è approvato da AIFA e rimborsato da parte del Sistema Sanitario Nazionale secondo la seguente indicazione (Determina n. 632/2023, GU Serie Generale n.251 del 26-10-2023): “ in monoterapia o in associazione con la terapia endocrina per il trattamento adiuvante di pazienti adulti con cancro della mammella allo stadio iniziale ad alto rischio, HER2-negativo, e con mutazioni nella linea germinale BRCA1/2, precedentemente trattati con chemioterapia neoadiuvante o adiuvante”, sulla base dei risultati dello studio di fase 3, randomizzato, OlympiA (Tutt ANJ, 2021; Geyer GE, 2022).
Nello studio OlympiA (Tutt ANJ, 2021) sono stati arruolati 1836 pazienti con VP gBRCA e carcinoma mammario HR+/HER2-negativo precedentemente trattati con terapia neoadiuvante o adiuvante, ad alto rischio di ripresa (se precedente trattamento neoadiuvante: assenza di pCR nei tumori Triplo negativi o assenza di pCR + CPS-EG score≥3 nei tumori HR+; se precedente trattamento adiuvante: ≥pN1 o ≥pT2 nei tumori Triplo negativi o ≥pN2 nei tumori HR+). I pazienti sono stati randomizzati (1:1) a ricevere olaparib (300 mg/os/due volte al giorno) per 1 anno verso placebo, dopo chemioterapia (neo)adiuvante. (Figura 1). La terapia ormonale nei pazienti a recettori positivi era data in concomitanza nell’89% dei pazienti.
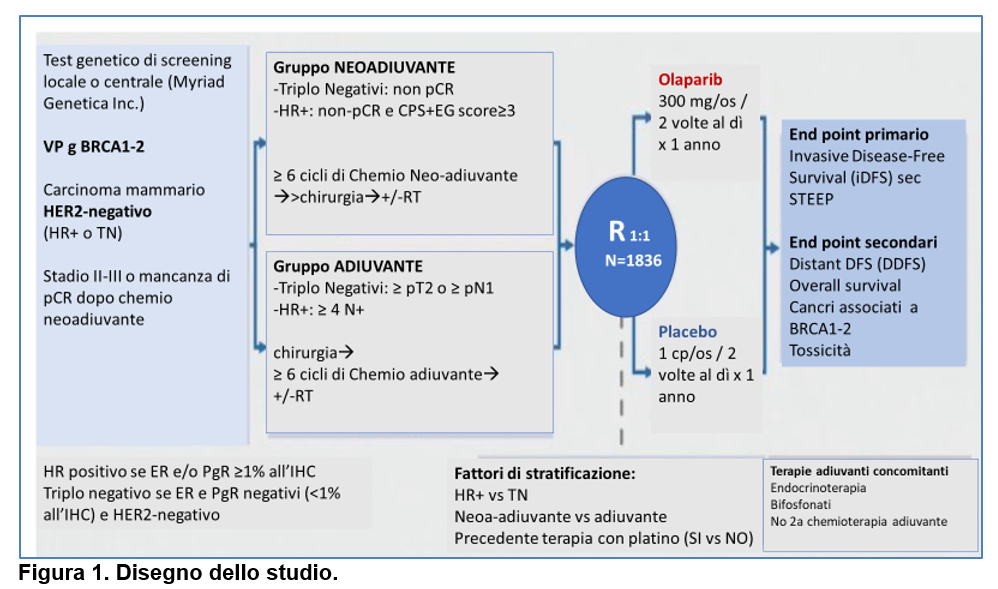
L’end-point primario era la invasive Disease-free Survival (iDFS) definita come tempo trascorso tra randomizzazione e data della prima comparsa di uno dei seguenti eventi ( secondo STEEP- Tolaney 2021) : tumore mammario invasivo omolaterale, tumore mammario invasivo controlaterale, secondo tumore primario invascvo, morte per ogni causa.
Gli end-point secondari comprendevano la Distant Disease-Free Survival (DDFS), la Overall Survival (OS) e la tossicità.
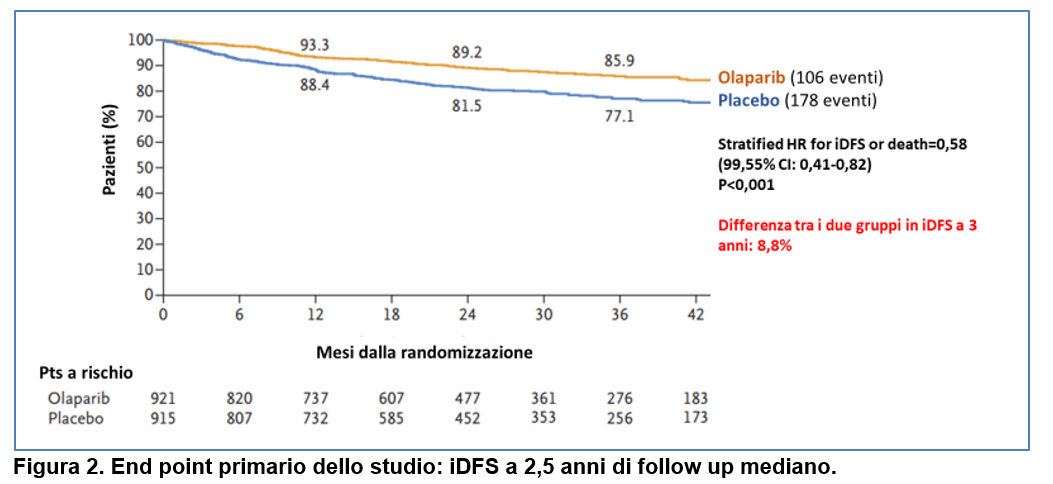
Alla prima analisi ad interim pre-pianificata, ad un follow-up mediano di 2,5 anni, l’IDFS era significativamente a favore del braccio con olaparib (85,9% vs 77,1%, (HR=0,58; 99,5%CI=0,50-0,78, p<0.001) (Figura 2).
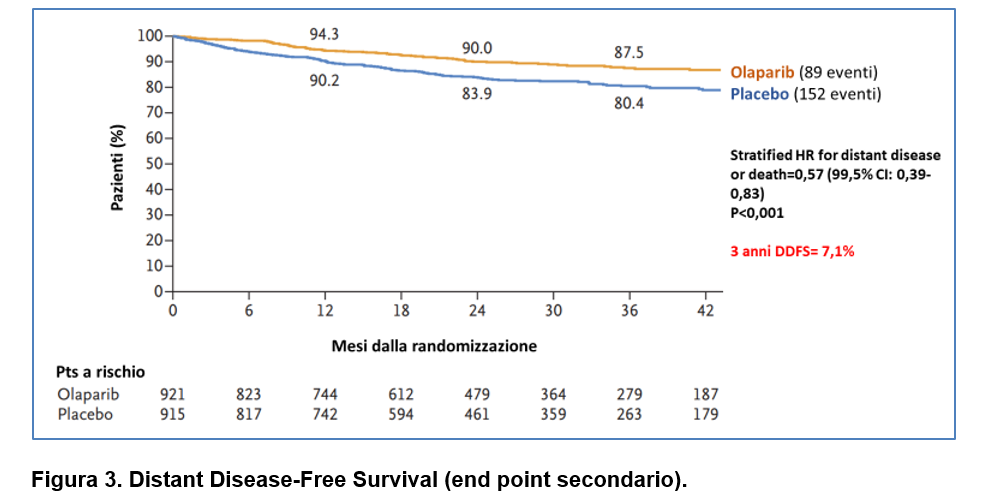
La Distant Disease-Free Survival a 3 anni era anch’essa statisticamente significativa a favore di olaparib (87,5% vs 80,4%, HR=0,57, 99,5% CI=0,39-0,83; p<0.001) (Figura 3).
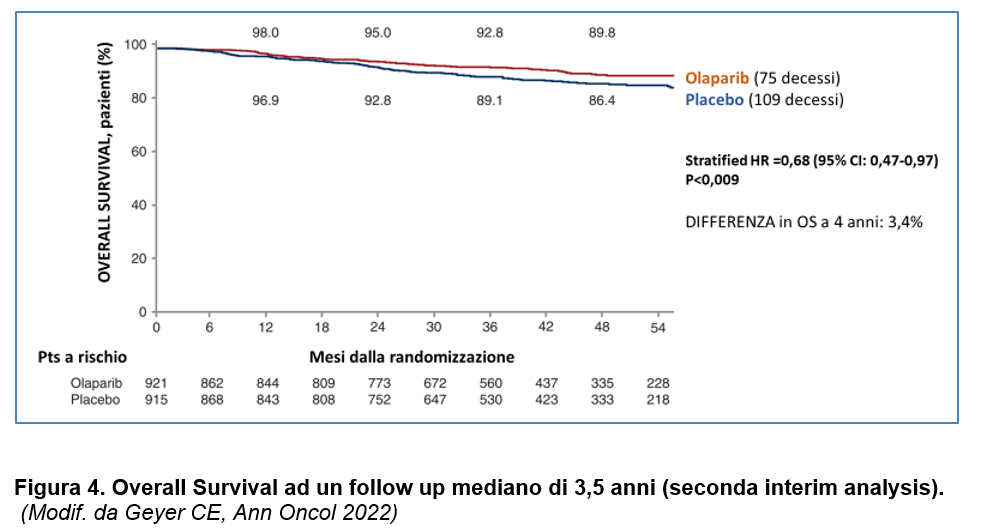
Per quanto riguarda l’OS, alla prima analisi ad interim non era stato evidenziato un vantaggio significativo di olaparib vs. placebo (Tutt ANJ, 2021).
Alla seconda analisi ad interim- ad un follow up mediano di 3,5 anni- la OS ha raggiunto la significatività statistica prepianificata con un vantaggio pari a 3,4% di sopravvivenza a favore del braccio sperimentale OS a 4 anni: (89.8% vs 86.4%, HR=0.68, 98,5% CI=0.47-0.97, p=0.009) (Figura 4) (Geyer CE, 2022).
I secondi tumori mammari controlaterali erano pari all’1.6% nel braccio con olaparib verso il 2% nel braccio placebo. I secondi tumori non mammari erano pari all’1.2% vs il 2.5% rispettivamente.
Per quanto riguarda la qualità di vita, un totale di 1751 pazienti è stato valutato mediante Patient Reported Outcomes senza evidenziare differenze significative tra i due bracci in termini di fatigue, mentre nausea e vomito risultavano essere significativamente più sfavorevoli nel braccio con olaparib nel primo anno di trattamento, con netto miglioramento durante il secondo anno fuori dalla terapia. Nel braccio con olaparib, eventi avversi di grado 3 o superiore avvenuti in più dell’1% dei pazienti erano: anemia (8.7%), neutropenia (4.8%), leucopenia (3.0%), fatigue (1.8%) e linfopenia (1.2%), mentre nessun evento avverso di grado 3 o superiore è avvenuto in più dell’1% dei pazienti randomizzati al braccio placebo.
Non è stato osservato alcun eccesso di leucemia mieloide acuta (AML) o di sindrome mielodisplastica (MDS).
A Dicembre 2024 -SAN ANTONIO BREAST CANCER CONFERENCE- SONO STATI PRESENTATI I RISULTATI DELLA SOPRAVVIVENZA GLOBALE AD UN FOLLOW UP MEDIANO DI 6,1 ANNI (terza “interim analysis” prespecificata; Garber JA, 2024).
In questa analisi aggiornata sono stati riportati i risultati della terza “”interim analysis” prespecificata con un follow-up mediano di 6,1 anni (massimo, 9,6 anni).
Sono state presentate analisi descrittive con un follow-up a più lungo termine che hanno confrontato l’endpoint primario IDFS e gli endpoint secondari chiave DDFS e OS tra il braccio olaparib e il braccio placebo.
Le stime dell’hazard ratio (HR) basate sul modello di rischio proporzionale di Cox stratificato (con intervalli di confidenza al 95%) sono state presentate per ciascun endpoint con i tassi di eventi riportati ad un un follow up mediano di 6 anni. Sono state riportate anche le analisi che includono gli eventi avversi di particolare interesse e tutti i decessi.
Risultati
Con un follow-up mediano più lungo e pari a 6,1 anni, il beneficio di olaparib in termini di IDFS, DDFS e OS è stato mantenuto con dimensioni di effetto simili a quelle riportate nelle analisi precedenti.
Per IDFS, l’HR è risultato pari a 0,65 (95% CI: 0,53- 0,78), con percentuali di IDFS a 6 anni del 79,6% per il gruppo Olaparib versus il 70,3% per il gruppo Placebo (differenza del 9,4%; 95% CI, 5,1%, 12,7%) (Figura 5).
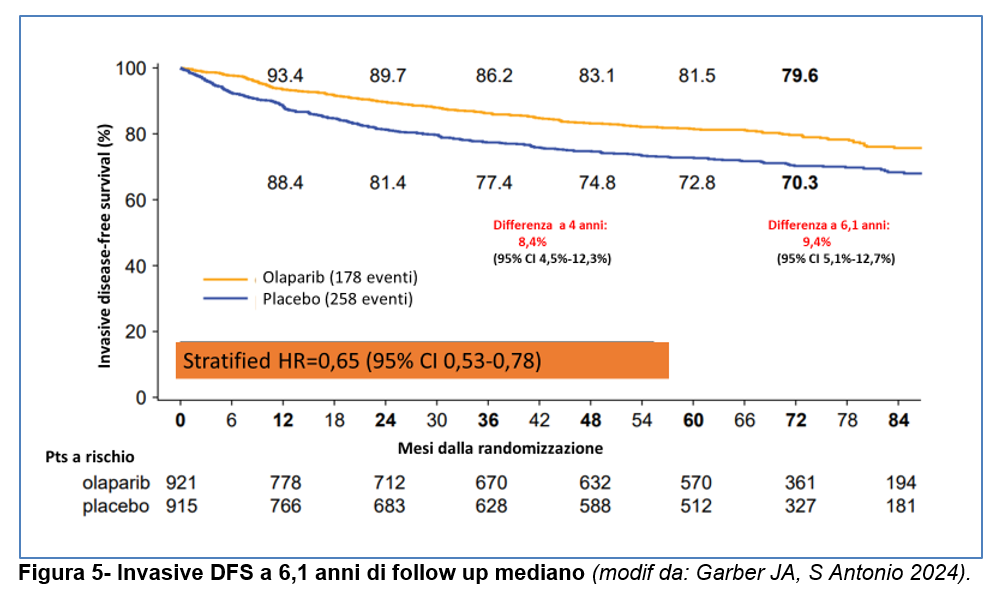

L’invasive-DFS (IDFS) nei tumori triplo negativi e nei tumori recettori ormonali positivi è riportata nella Figura 6.
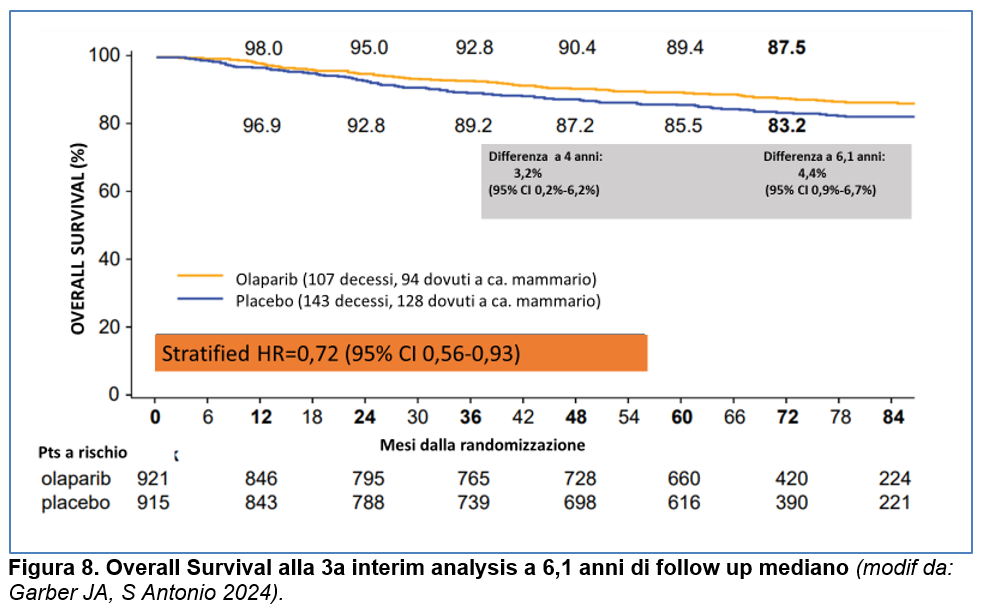
Per la Distant-DFS (DDFS), l’HR è risultato essere pari a 0,65 (95% CI: 0,53- 0,81) con percentuali di DDFS a 6 anni dell’ 83,5% per Olaparib versus 75,7% per Placebo (differenza del 7,8%; 95% CI, 3,8%- 11,5%) (Figura 7).
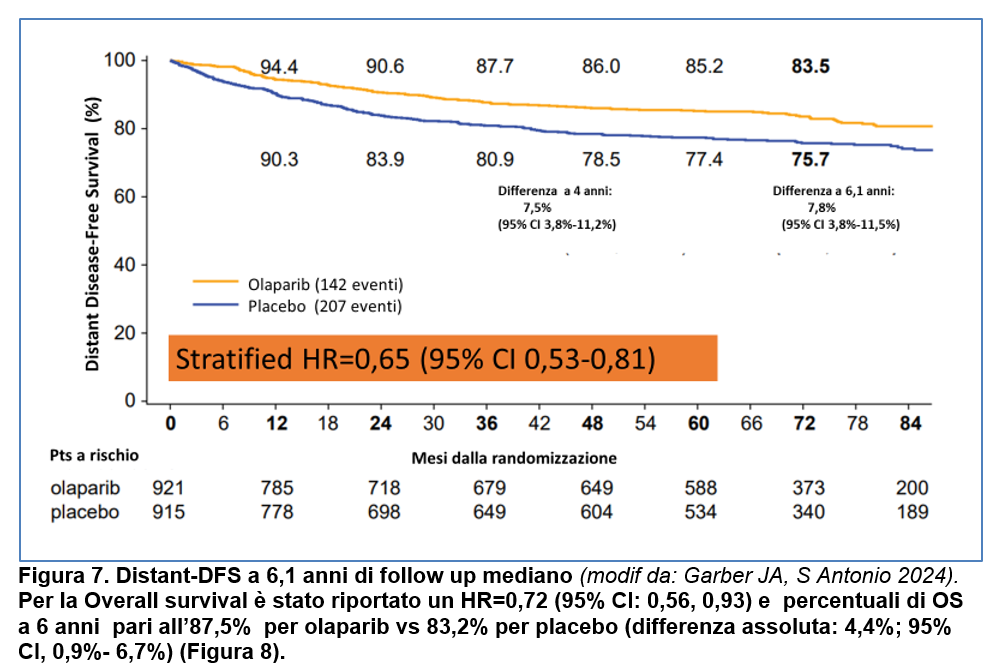

Con Olaparib è stato riportato un minor numero di tumori associati a BRCA rispetto a Placebo:
carcinoma mammario invasivo controlaterale: 34 versus 42;
carcinoma mammario NON invasivo controlaterale: 3 versus 4;
nuovo tumore ovarico primario o nuovo tumore primario delle tube di Falloppio: 5 versus 14.
La percentuale di pazienti con eventi avversi di interesse speciale è risultata inferiore con Olaparib rispetto a Placebo (6,3% vs 9,3%).
In particolare, sono stati riportati:
- Mielodisplasia (MDS) o Leucemia mieloide acuta (AML): 4 casi (0,4%) con Olaparib versus 6 (0,7%) con Placebo;
- Polmoniti: 9 casi (1%) con Olaparib versus 13 casi (1,4%) con Placebo;
- Nuovi tumori primitivi:45 (4,9%) con Olaparib versus 68 (7,5%) con Placebo.
CONCLUSIONI
A 6,1 anni di follow up mediano, un anno di Olaparib adiuvante dopo chemioterapia (neo)adiuvante continua a dimostrare miglioramenti significativi in IDFS, DDFS e OS in pazienti con carcinoma mammario in fase precoce e mutazione germinale di BRCA1-2 ad alto rischio, HER2-negativo, compresi tutti i sottogruppi chiave, con una tossicità accettabile e nessuna evidenza di aumento del rischio di MDS o AML.
Il follow up in cieco per l’analisi finale pianificata continuerà fino a giugno 2029 (a 15 anni dall’arruolamento del primo paziente nello studio).
Questi dati continuano a sottolineare l’importanza del test germinale di BRCA 1-2 nel carcinoma mammario in fase precoce ad alto rischio.
BIBLIOGRAFIA
Tutt ANJ, Garber JE, Kaufman B, et al. Adjuvant olaparib for patients with BRCA1- or BRCA2-mutated breast cancer. N Engl J Med. 2021;384(25):2394-2405.
Tolaney SM, Garrett-Mayer E, White J, Blinder VS, Foster JC, Amiri-Kordestani L, Hwang ES, Bliss JM, Rakovitch E, Perlmutter J, Spears PA, Frank E, Tung NM, Elias AD, Cameron D, Denduluri N, Best AF, DiLeo A, Baizer L, Butler LP, Schwartz E, Winer EP, Korde LA. Updated Standardized Definitions for Efficacy End Points (STEEP) in Adjuvant Breast Cancer Clinical Trials: STEEP Version 2.0. J Clin Oncol. 2021 Aug 20;39(24):2720-2731
Geyer CE Jr, Garber JE, Gelber RD, et al. OlympiA Clinical Trial Steering Committee and Investigators. Overall survival in the OlympiA phase III trial of adjuvant olaparib in patients with germline pathogenic variants in BRCA1/2 and high-risk, early breast cancer. Ann Oncol. 2022 Dec;33(12):1250-1268.
Tutt ANJ, Garber J, Gelber RD, et al. Pre-specified event driven analysis of overall survival (OS) in the OlympiA phase III trial of adjuvant olaparib (ol) in germline BRCA1/2 mutation (gBRCAm) associated breast cancer. Presented at: March 2022 ESMO Virtual Plenary; March 16-18, 2022.
Garber JA et al. OlympiA: A phase 3, multicenter, randomized, placebo-controlled trial of adjuvant olaparib after (neo)adjuvant chemotherapy in patients w/ germline BRCA1 & BRCA2 pathogenic variants & high risk HER2-negative primary breast cancer: longer term follow -up. Presented at: San Antonio Breast Cancer Conference; December 10-13, 2024; San Antonio, TX. Abstract # GS1-09


