NUOVE INDICAZIONI RIMBORSATE DI TRASTUZUMAB DERUXTECAN: G.U. del 20 dicembre 2023
Nella Gazzetta Ufficiale n.296 del 20-12-2023 è stato pubblicata la determinata AIFA del 15 dicembre 2023 n.760/2023 con le nuove indicazioni terapeutiche di TRASTUZUMAB deruxtecan ai fini della rimborsabilità:
- In monoterapia per il trattamento di pazienti adulti con adenocarcinoma dello stomaco o della giunzione gastroesofagea (GES) avanzato HER2-positivo, che hanno ricevuto un precedente regime a base di trastuzumab;
- In monoterapia per il trattamento di pazienti adulti con cancro della mammella HER2-low non resecabile o metastatico, che hanno ricevuto precedentemente chemioterapia per malattia metastatica o che hanno sviluppato recidive della malattia durante o entro sei mesi dal completamento della chemioterapia adiuvante (INNOVATIVITA’ PIENA);
e l’indicazione terapeutica già rimborsata:
- in monoterapia per il trattamento di pazienti adulti con cancro della mammella HER2-positivo non resecabile o metastatico, che hanno ricevuto uno o più precedenti regimi a base di anti-HER2 nel setting metastatico o hanno presentato una progressione di malattia durante un trattamento (neo)adiuvante o entro 6 mesi dalla sua interruzione (INNOVATIVITA’ PIENA).
A-TRASTUZUMAB DERUXTECAN NEL CARCINOMA MAMMARIO METASTATICO HER2-low
L’indicazione rimborsata di trastuzumab deruxtecan nel carcinoma mammario avanzato HER2-low si basa su risultati dello studio clinico di fase III randomizzato DESTINY-Breast 04 (Modi S. et al, N ENGL J MED 2022; 387: 9-20). In questo studio randomizzato di fase III, è stata valutata efficacia e tollerabilità del trastuzumab deruxtecan rispetto alla chemioterapia a scelta del medico in pazienti con carcinoma mammario metastatico HER2-low, in considerazione dei risultati ottenuti in questa popolazione in studi di fase I e II legati al meccanismo d’aione del farmaco (figura 1).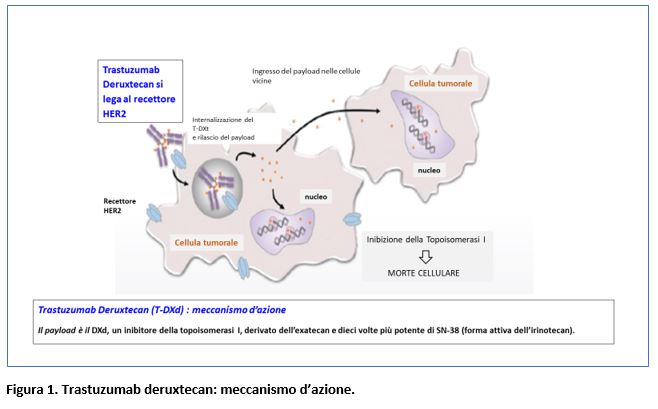
METODI
In questo studio di fase III sono stati arruolati pazienti con carcinoma mammario metastatico HER2-low con recettori ormonali positivi (ER o PgR ≥ 1%) (HR-positivi) e con recettori ormonali negativi (HR-negativi). Lo status HER2-low era definito da valori di IHC 1+ oppure 2+ e ISH negativo. I pazienti dovevano aver ricevuto una o due precedenti linee di chemioterapia per la malattia metastatica oppure aver avuto una ripresa di malattia durante o entro i 6 mesi dopo il completamento della chemioterapia adiuvante. I pazienti con recettori ormonali positivi dovevano aver ricevuto almeno una linea di endocrinoterapia. I pazienti sono stati randomizzati a ricevere (2:1) Trastuzumab-deruxtecan (5,4 mg/kg/ IV ogni 3 settimane) oppure chemioterapia a scelta del medico.
L’endpoint primario era la PFS nella corte di pazienti con recettori ormonali positivi (HR+) (valutata in cieco da una revisione centrale indipendente).
Tra gli endpoint secondari, erano inclusi i PFS di tutta la popolazione, la OS della coorte HR+ e di tutti i pazienti, la risposta obiettiva, la durata della risposta e l’efficacia nella corte HR-negativa. La tollerabilità è stata graduata secondo NCI-CTCAE v.5.
RISULTATI
Da dicembre 2018 a dicembre 2021 sono stati randomizzati (2:1) 557 pazienti: 373 al gruppo Trastuzumab deruxtecan e 174 al gruppo chemioterapia.
Trastuzumab deruxtecan è stato somministrato al dosaggio di 5,4 mg/Kg/IV ogni 3 settimane.
L’88,7% dei pazienti arruolati erano HR+ e l’11,3% erano HR-negativi.
Il 70,5% delle pazienti HR+ avevano ricevuto inibitori delle cellule CDK4/6.
Il numero mediano di linee di terapia ricevuta per malattia metastatica nella popolazione arruolata è stato pari a 3.
Nel gruppo chemioterapia a scelta dello sperimentatore, i pazienti hanno ricevuto eribulina (51,1%), capecitabina (20,1%), nab-paclitaxel (10,3%), gemcitabina (10,3%) o paclitaxel (8,2%).
Alla data dell’ analisi primaria di efficacia (11 gennaio 2022), i risultati relativi all’endpoint primario (PFS nei pazienti HERZ low/HR+) sono stati i seguenti.
- PFS mediana: 10,1 mesi con Trastuzumab deruxtecan vs 5,4 mesi con chemioterapia (HR per progressione di malattia o morte = 0,51; 95% CI 0,40-0,64; p < 0,001);
- Il beneficio per Trastuzumab deruxtecan in PFS mediana è stato consistente in tutti i sottogruppi analizzati. Nel gruppo HER2-low/HR+ trattato con Trastuzumab deruxtecan, la PFS mediana è stata di 10,3 mesi nei pazienti HER2/IHC 1+ e di 10,1 mesi nei pazienti HER2/IHC2 + e ISH non amplificato. Nel gruppo HER-low/HR+ pretrattati con inibitori CDK4/6, la PFS mediana è stata di 10 mesi e di 11,7 mesi nel gruppo non pretrattato con inibitori di CDK4/6.
- La PFS mediana in tutta la popolazione arruolata HER2low (HR+ e HR-negativo) -endpoint secondario- è stato pari a 9,9 mesi con Trastuzumab deruxtecan e di 5,1 mesi con chemioterapia (HR = 0,50; 95% CI 0,40-0,63: p < 0.001).
- Ad un follow up mediano di 18,4 mesi, la OS mediana nella coorte HR+ -altro endpoint secondario- è stata di 23,9 mesi con Trastuzumab deruxtecan e di 17,5 mesi con chemioterapia (HR= 0,64; 95% CI 0,48-0,86; p = 0.003) e in tutta la popolazione -altro endpoint secondario- è stata di 23,4 mesi con Trastuzumab deruxtecan e 16,8 con chemioterapia (HR = 0,64; 95% CI 0,49-0,84; p = 0.001). La OS mediana nella coorte HER2low/HR-negativo è stata di 18,2 mesi con Trastuzumab deruxtecan e 8,3 mesi con chemioterapia (HR = 0,48; 95% CI 0,24-0,95). Il tasso di risposte obiettive confermate nella coorte HR+ è stato di 52,6% con Trastuzumab deruxtecan vs 16,3% con chemioterapia, con una durata mediana della risposta di 10,7 mesi vs 6,8 mesi. Tra tutti i pazienti, la ORR è stata di 52,3% vs 16,3% e nella coorte HR-negativa è stata di 50% vs 16,7%. Gli eventi avversi di grado 3 o superiore, si sono verificati nel 52,6% dei pazienti che avevano ricevuto Trastuzumab deruxtecan e nel 67,4% dei pazienti trattati con chemioterapia. Polmoniti interstiziali sono state riportate in 45 pazienti, pari al 12,1% dei pazienti che avevano ricevuto Trastuzumab deruxtecan: in 13 pazienti (3,5%) di grado 1, in 24 (6,5%) di grado 2, in 5 (1,3%) di grado 3 e in 3 pazienti (0,8%) di grado 5.
CONCLUSIONI
In questo trial che ha arruolato pazienti con carcinoma mammario metastatico HER2-low, Trastuzumab deruxtecan ha determinato una significativamente più lunga PFS e OS rispetto alla chemioterapia a scelta del medico sperimentatore.
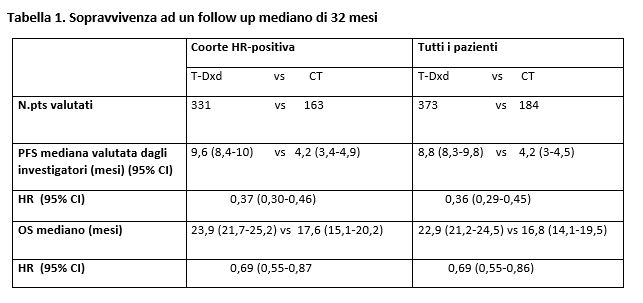
All’ESMO 2023, tenutasi ad ottobre 2023, Modi S. et al. hanno presentato i risultati a 32 mesi di follow up mediano, che hanno confermato il vantaggio in PFS e in OS con Trastuzumab-Deruxtecan rispetto a chemioterapia sia nella coorte HR+ che in tutta la popolazione (Tabella 1)
Una analisi esplorativa ha valutato i pazienti HR-negativi. A 32 mesi di follow up mediano, la OS mediana è stata di 17 mesi vs 8,3 mesi (HR = 0,58; 95% CI 0,31-1,08) e la PFS mediana di 6,3 mesi vs 2,9 mesi ( HR = 0,29; 95% CI 0,15-0,57) con una riduzione del 42% del rischio di morte e del 71% del rischio di progressione e morte con Trastuzumab-Deruxtecan. Non sono stati riportati nuovi dati relativi alla tollerabilità.
Bibliografia
Modi S.; Jacot W.; Yamashita T; et al. Trastuzumab Deruxtecan in previously treated HER2-low advanced breast cancer. N.Engl.J.Med. 2022; 387: 9-20
link all’abstract
https://pubmed.ncbi.nlm.nih.gov/35665782/
Modi S; Jacot W; Iwata H.; et al. Trastuzumab deruxtecan (T-Dxd) versus treatment of physician’s choice (TPC) in patients with HER2-low unresctable and/or metastatic breast cancer: updated survival results of the randomized, phase 3 DESTINITY-Breast04 STUDY. Ann.Oncol. 2023; 34 (Suppl2): s334-s335.
B- TRASTUZUMAB DERUXTECAN nell’adenocarcinoma gastrico o della giunzione gastroesofagea avanzato HER2-positivo.
La rimborsabilità del Trastuzumab deruxtecan in Italia è arrivata con pubblicazione sulla GU del 20 dicembre 2023 che sancisce che trastuzumab deruxtecan in monoterapia è indicato per il trattamento di pazienti adulti con adenocarcinoma dello stomaco o della giunzione gastroesofagea (GEJ) avanzato HER2-positivo, che hanno ricevuto un precedente regime a base di trastuzumab.
L’adenocarcinoma gastrico o della giunzione esofago-gastrica avanzato HER 2-positivo rappresenta circa 1 su 5 casi.
L’approvazione da parte della Commissione Europea faceva seguito al parere positivo espresso dal Committee for Medicinal Products for Human Use nel novembre 2022 e si basa sui risultati degli studi di fase 2 DESTINY-Gastric02 e DESTINY-Gastric01.
DESTINY-Gastric01 TRIAL
Nello studio di fase II randomizzato sono stati arruolati pazienti con adenocarcinoma gastrico o delle giunzione gastro-esofagea HER2+ (3+ all’IHC oppure 2+ e ISH amplificato) in progressione dopo almeno due linee di terapia sistemica per le malattie avanzata o metastatica. Tutti dovevano aver ricevuto Trastuzumab. 188 pazienti arruolati in centri oncologici del Giappone e della Corea del Sud sono stati randomizzati (2:1) a ricevere Trastuzumab deruxtecan (6,4 mg/kg/ IV ogni 3 settimane) oppure chemioterapia a scelta dell’investigatore (irinotecano 150 mg/mg/IV ogni 2 settimane oppure paclitaxel 80 mg/mg/ IV dai 1-8 e 15 ogni 4 settimane). Dei 187 pazienti trattati, 125 hanno ricevuto Trastuzumab deruxtecan e 62 chemioterapia (55 irinotecano e 7 paclitaxel). Una risposta obiettiva in accordo a una revisione centrale indipendente -endpoint primario- è stata riportata nel 51% dei pazienti del gruppo Trastuzumab deruxtecan vs 14% dei pazienti del gruppo chemioterapia (p = 0,001) con 11% di RC vs 0%. La sopravvivenza globale -endpoint secondario valutato gerarchicamente solo se l’endpoint primario risultava statisticamente significativo- è stata più lunga con Trastuzumab deruxtecan che con la chemioterapia (OS mediana: 12,5 vs 8,4 mesi; HR = 0,5; 95% CI 0,39-0,88; p=0,01 che incrociava il livello prespecificato di O’Brien-Fleming). Gli eventi avversi più comuni di grado ≥ 3 sono stati la neutropenia (51% con T-DXt vs 24% con chemioterapia), anemia (38% vs 23%) e leucopenia (21% vs 11%). Una polmonite interstiziale è stata riportata in 12 pazienti (grado 1 o 2: 9 pazienti; grado 3 o 4: 3 pazienti) con un decesso da polmonite.
DESTINY-Gastric02
Nello studio di fase II a braccio singolo DESTINITY-Gastric02 sono stati arruolati 79 pazienti statunitensi ed europei, con carcinoma dello stomaco (34%) o della giunzione gastroesofagea (66%) metastatico o non operabile HER2-positivo (3+ all’IHC oppure 2+ e ISH amplificato), in progressione durante o dopo una 1a linea con un regime contenente Trastuzumab,) e con PS 0-1. L’endpoint primario era il tasso di risposte obiettive confermate da una revisione indipendente centralizzata. Il Trastuzumab deruxtecan è stato somministrato alla dose di 6,4 mg/kg/IV ogni 3 settimane. All’analisi primaria (a un follow up mediano di 5,9 mesi) è stata riportata una risposta obiettiva confermata in 30 (38%) dei 79 pazienti (4% RC e 34% RP). All’analisi aggiornata e ad un follow up mediano di 10,2 mesi, una risposta obiettiva confermata è stata riportata con Trastuzumab deruxtecan in 33 dei 79 pazienti (42%), con 5% RC e 37% RP. La durata mediana della risposta è stata di 8,1 mesi. Il tempo mediano alla risposta è stato di 1,4 mesi.
All’analisi effettuata a un follow up di 10,2 mesi, la PFS mediana è stata di 5,6 mesi e la OS mediana di 19,1 mesi. Gli eventi avversi più comuni di grado ≥ 3 sono stati anemia (14%), nausea (8%), neutropenia (8%) e leucopenia (6%). Sono stati riportati due decessi (3%), associati al trattamento e sono stati causati da malattia polmonare interstiziale o polmonite. La PFS mediana è stata di 5,6 mesi (95% CI 4,2-8,3) e le OS mediana di 12,1 mesi (95% CI 9,4-15,4 mesi).
COMMENTO
I risultati degli studi di fase II DESTINY-Gastric01 e DESTINY-Gastric02 hanno evidenziato che il Trastuzumab deruxtecan determina un tasso di risposte obiettive rilevante sia nei pazienti pretrattati con 2 o più linee (DESTINY-Gastric 01) che nei pazienti trattati con una sola linea di terapia per la malattia localmente avanzata o metastatica HER2+ (DESTINY-Gastric02) comprendente Trastuzumab. Il profilo di tollerabilità di Trastuzumab deruxtecan è stato in linea con quanto osservato in altri studi.
In Italia nel 2023 sono stimate circa 15.000 nuove diagnosi di tumore gastrico o della giunzione esofago-gastrica, con una sopravvivenza netta a 5 anni di circa il 30% negli uomini e 35% nelle donne.
TDXd è il primo anticorpo coniugato approvato in Europa per il tumore gastrico avanzato: un importante passo avanti nel trattamento di questa neoplasia.
È in corso lo studio clinico di fase III DESTINY-Gastric04.
Bibliografia
Shitara K., et al., for the DESTINY-Gastric01 Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer. N Engl J Med 2020; 382:2419-2430
DOI: 10.1056/NEJMoa2004413
Van Cutsem E., et al. Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study. Lancet Oncol 2023 2023 Jul;24(7):744-756. doi: 10.1016/S1470-2045(23)00215-2. Epub 2023 Jun 14.


