HER2CLIMB-02: RANDOMIZED, DOUBLE-BLIND PHASE 3 TRIAL OF TUCATINIB AND TRASTUZUMAB EMTANSINE FOR PREVIOUSLY TREATED HER2-POSITIVE METASTATIC BREAST CANCER.
Hurvitz S.A. et al.
San Antonio Breast Cancer Symposium, December 5-9 , 2023
Al SABCS 2023 sono stati presentati i risultati dell’analisi primaria dello studio clinico di fase III randomizzato, doppio cieco, placebo controllato, HER2CLIMB-02.
Lo studio ha confrontato la combinazione tucatinib e T-DM1 rispetto alla combinazione placebo e T-DM1, in considerazione dei risultati dello studio di fase II HER2CLIMB (tucatinib- un TKI selettivo anti-HER2- aggiunto a trastuzumab e capecitabina aumentava in maniera statisticamente significativa la PFS e la OS dei pazienti con carcinoma mammario metastatico HER2+ e aumentava la PFS nei pazienti con metastasi cerebrali; Murphy et al, NEJM 2020) e alla luce dei dati preclinici e di fase Ib che indicavano una aumentata attività antitumorale con la combinazione di tucatinib e T-DM1, anche a livello intracerebrale (Olson et al, Cancer Res Comm 2023; Borges et al,JAMA Oncol 2018).
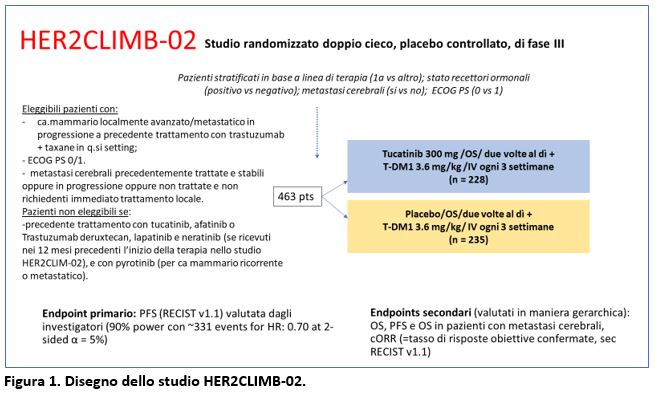
Lo studioHER2CLIMB-02 ha arruolato 463 pazienti con carcinoma mammario localmente avanzato o metastatico HER2-positivo in progressione a precedente trattamento con trastuzumab + taxane in qualsiasi setting e con PS (ECOG) 0-1. Erano eleggibili pazienti con metastasi cerebrali precedentemente trattate e stabili oppure in progressione oppure non trattate e non richiedenti immediato trattamento locale (Figura 1).
I pazienti sono stati stratificati in base a: linea di trattamento per la malattia metastatica (1alinea vs altro); stato dei recettori ormonali ( positivo vs negativo); presenza o storia di metastasi cerebrali ( si vs no); PS sec. ECOG (0 vs 1).
Non erano eleggibili pazienti precedentemente trattati con tucatinib, afatinib o trastuzumab deruxtecan, lapatinib e neratinib (se rivevuti nei 12 mesi precedenti l’inizio della terapia nbello studio HER2CLIMB-02) e con pyrotinib ( per ca mammario ricorrente o metastatico).
I pazienti sono stati randomizzati (1:1) a ricevere TDM-1 + tucatinib oppure TDM-1 + placebo (Figura 1).
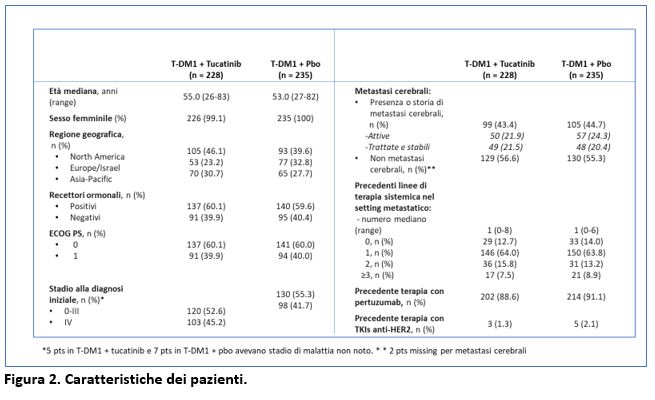
Circa il 44% dei pazienti arruolati nello studio aveva metastasi cerebrali e circa la metà di questi pazienti aveva metastasi cerebrali attive (Figura 2).
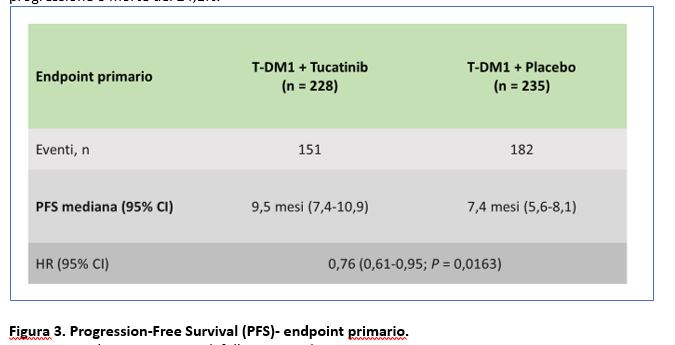
Ad un follow up mediano di 24,4 mesi, la Progression-Free Survival mediana (PFS=tempo mediano alla progressione di malattia o morte) era di 9,5 mesi per il gruppo trattato con TDM-1 + tucatinib versus 7,4 mesi per il gruppo trattato con TDM-1+placebo (HR=0,76; 95% CI 0,61-0,95; p=0,0163) (Figura 3), con un guadagno in termini assoluti di oltre 2 mesi. La differenza è risultata essere statisticamente significativa e la combinazione TDM1+ Tucatinib ha ridotto il rischio di progressione o morte del 24,1%.
Risultati a 24,4 mesi di follow up mediano.
Gli HRs per i vari sottogruppi è stato consistente con quello della popolazione globale.
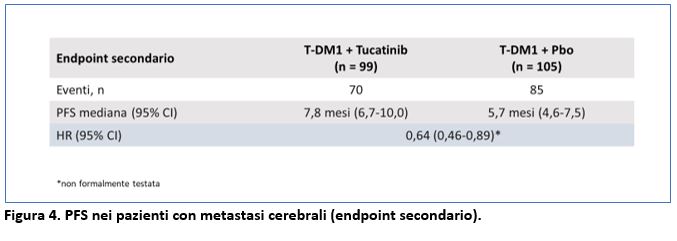
La PFS per i pazienti con metastasi cerebrali (un endpoint secondario) è stata di 7,8 mesi per il gruppo TDM-1+tucatinib vs 5,7 mesi per il gruppo TDM-1+placebo ( HR=0,64; 95% CI 0,46-0,89). Non è stato formalmente testato il p value (Figura 4) a causa del disegno gerarchico dell’analisi statistica dello studio.
La prima analisi ad interim della sopravvivenza globale è stata effettuata visto il risultato statisticamente positivo della PFS nella popolazione globale, ma non è stata riscontrata alcuna differenza significativa in OS tra i due gruppi di trattamento. Tuttavia, i dati sono immaturi per la OS, con 71 decessi nel gruppo TDM-1 e tucatinib vs 65 nel gruppo TDM-1 e placebo.
Il profilo di tossicità è risultato in linea con quanto precedentemente riportato.
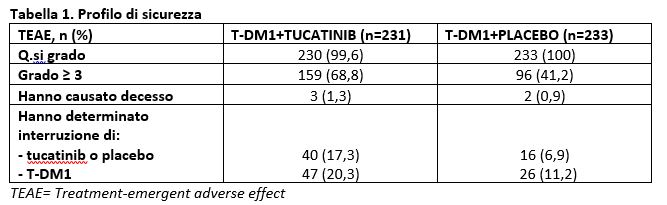
-Il più comune TEAE che ha portato a interruzione di tucatinib o placebo è stato l’aumento dell’enzima epatico ALT (alanina aminotransferasi; SGPT) : 2,6% vs 0%.
-Gli eventi avversi che più frequentemente hanno portato a interruzione di T-DM1 (associato a Tucatinib oppure a Placebo) sono stati:
– aumento di ALT (2,2% vs 0%);
-piastrinopenia (2,2% vs 0%);
-malattia polmonare interstiziale (0% vs 2,1%).
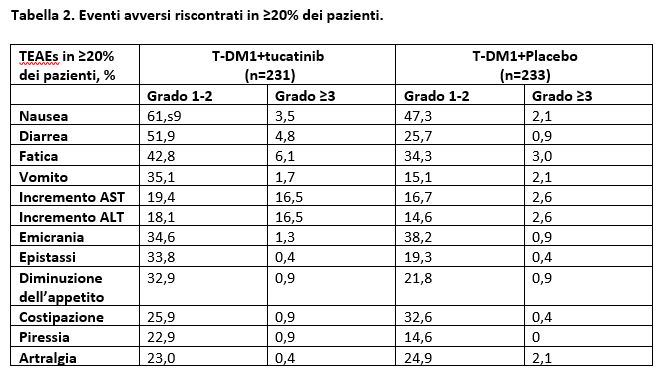
-Gli eventi avversi epatici di grado ≥ 3 sono stati più frequenti nella combinazione contenente Tucatinib (28,6% vs 7,3%) e solitamente legati ad un aumento di AST/ALT. L’85% degli eventi avversi epatici di qualsiasi grado verificatesi nel gruppo Tucatinib si è risolto oppure è tornato al grado 1 (mediana: 22 giorni). L’evento avverso diarrea di grado 3 è stato riportato nel 4,8% del gruppo Tucatinib vs 0,9% del gruppo Placebo + TDM-1. Nella Tabella 2 sono riportati gli eventi avversi riscontrati in ≥ 20% dei pazienti.
Bibliografia
- Hurvitz SA, Loi S, O’Shaughnessy J, et al. HER2CLIMB-02: primary analysis of a randomized, double-blind phase 3 trial of tucatinib and trastuzumab emtansine for previously treated HER2-positive metastatic breast cancer. Presented at: 2023 San Antonio Breast Cancer Symposium; December 5-9, 2023; San Antonio, Texas. Abstract GS01-10.
- FDA approves first new drug under international collaboration, a treatment option for patients with HER2-Positive metastatic breast cancer. FDA. April 17, 2020. Accessed December 6, 2023. https://www.fda.gov/news-events/press-announcements/fda-approves-first-new-drug-under-international-collaboration-treatment-option-patients-her2
- Murphy RK, Loi S, Okines A, et al. Tucatinib, trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. N Engl J Med. 2020;382(7):597-609.
COMMENTO
Lo studio HER2CLIM02 è il secondo studio randomizzato che ha incluso pazienti con metastasi cerebrali (circa il 44%), dopo lo studio HER2CLIMB ( Murphy et al, NEJM 2020), riportando con un regime contenente tucatinib un ritardo nella progressione di malattia anche in queste pazienti.
In Italia, al momento Tucatinib è autorizzato e rimborsato a seguito della pubblicazione della Determina AIFA nella GU n. 268 del 16/11/2022, per la seguente indicazione terapeutica: “in associazione a trastuzumab e capecitabina per il trattamento di pazienti adulti affetti da cancro della mammella localmente avanzato o metastatico HER2 positivo che abbiano ricevuto almeno 2 precedenti regimi di trattamento anti HER2”
In Italia, T-DM1, nel setting avanzato, è autorizzato e rimborsato per “il trattamento di pazienti adulti affetti da tumore mammario HER2-positivo, inoperabile, localmente avanzato o metastatico, sottoposti in precedenza a trattamento con trastuzumab e un taxano, somministrati separata mente o in associazione. I pazienti devono: essere stati sottoposti in precedenza a terapia per la malattia localmente avanzata o metastatica; oppure aver sviluppato recidiva di malattia nel corso di o entro sei mesi dal completamento della terapia adiuvante”.
Per la indicazione di questi due farmaci nel trattamento di pazienti con carcinoma mammario HER2+ e metastasi cerebrali, consultare la versione 2023 della Linea Guida AIOM CARCINOMA MAMMARIO AVANZATO sul SNLG:
https://www.iss.it/documents/20126/8403839/LG_C008_AIOM_Ca-mammario-avanzato-TTT2.pdf



