
Randomized Phase III Study Comparing Neoadjuvant Chemotherapy Followed by Surgery Versus Chemoradiation in Stage IB2-IIB Cervical Cancer: EORTC-55994
Kenter GG, Greggi S, Vergote I, Katsaros D, Kobierski J, van Doorn H, Landoni F, van der Velden J, Reed N, Coens C, van Luijk I, Colombo N, Steen-Banasik EV, Ottevanger N, Casado A; EORTC-55994 Study Group.
J Clin Oncol. 2023 Nov 10;41(32):5035-5043. doi: 10.1200/JCO.22.02852. Epub 2023 Sep 1. PMID: 37656948.
Il carcinoma della cervice uterina è ancora la quarta causa di morte per cancro nelle donne nel mondo.
Questo studio del Gynecological Cancer Group- EORTC (European Organisation for Research and Treatment of Cancer) è stato condotto in considerazione delle evidenze contrastanti sul valore della chemioterapia neoadiuvante prima della chirurgia (NACT-S) rispetto alla chemio-radioterapia concomitante (CCRT) nello stadio IB2-IIB del carcinoma cervicale. Alla fine degli anni Novanta si sono sviluppati due approcci consecutivi per migliorare i risultati del trattamento del carcinoma della cervice uterina: chemioterapia neoadiuvante seguita da chirurgia (NACT-S) e chemio-radioterapia concomitante (CCRT): entrambi gli approcci si sono dimostrati efficaci in diversi studi (Sardi 1998; Benedetti-Panici 2002).
Allo stesso tempo, il National Cancer Institute ha indicato nel 1999 che, sulla base di numerosi studi randomizzati e controllati, si dovrebbe prendere in forte considerazione l’aggiunta di chemioterapia a base di cisplatino alla radioterapia (McNeil 1999).
Dal momento che entrambi gli approcci sono risultati superiori alla sola radioterapia (Cochrane 2004), questo studio ha voluto verificare se la NACT-S fosse superiore alla CCRT in pazienti con carcinoma della cervice stadio IB2, IIA2 o IIB secondo FIGO (Prat 2014) (Figura 1).
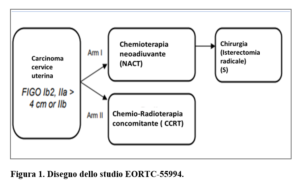
METODI
Tra maggio 2002 e gennaio 2014, 626 pazienti con carcinoma della cervice (adenocarcinoma; carcinoma squamoso; carcinoma adenosquamoso) stadio FIGO IB2-IIb sono state randomizzate tra chemioterapia neoadiuvante seguita da intervento chirurgico (NACT-S; n=314) e CCRT standard (n=312).
L’end point primario era il tasso di sopravvivenza globale (OS) a 5 anni. Tra gli end point secondari: sopravvivenza libera da progressione, tossicità e qualità di vita (HRQOL).
Nel braccio Chemioterapia neoadiuvante seguito da chirurgia (NACT-S) la chemioterapia doveva essere basata sul cisplatino. La chirurgia (eseguita entro 6 settimane dall’ultima somministrazione di chemioterapia neoadiuvante) includeva una isterectomia totale con resezione dei parametri, della parte superiore della vagina (2-3 cm), del paracolpo e linfoadenectomia completa comprendente almeno i linfonodi esterni, iliaci comuni e otturatori (nel caso di linfonodi pelvici sospetti, esame al criostato e se positivi, era fortemente raccomandata la linfoadenectomia para-aortica, almeno fino all’arteria mesenterica inferiore).In questo braccio, la radioterapia post-chirurgica veniva raccomandata in caso di linfonodi istologicamente positivi o di invasione del tumore nei parametri o a meno di 5 mm dai margini di resezione ( secondo le indicazioni derivanti dallo studio di Benedetti Panici, JCO 2002).
Nella braccio chemio-radioterapia concomitante (CCRT) era indicato cisplatino settimanale (massimo 6 settimane) e radioterapia (RT esterna sulla pelvi-45-40 Gy- con o senza boost esterno, seguita da brachiterapia). Una successiva isterectomia era permessa, ma non raccomandata, nel caso di tumore residuo istologicamente dimostrato.
RISULTATI
Dopo un follow-up mediano di 8,7 anni, 198 pazienti (31,6%) risultavano deceduti.
Età (46-47 anni), stadio e istologia ( carcinoma squamoso: 85%; Adenocarcinoma ~10%; carcinoma adenosquamoso ~ 5%) erano bilanciati in entrambi i bracci.
Il trattamento previsto dal protocollo è stato completato in 223 dei 314 (71%) pazienti nel braccio NACT-S e in 257 dei 312 (82%) nel braccio CCRT. I principali motivi per non aver completato il trattamento previsto sono stati:
tossicità (30 su 314; 9,6%) e progressione di malattia (21 su 314; 6,7%) nel braccio NACT-S;
tossicità (23 su 312; 7,4%) e rifiuto dei pazienti (13 su 312; 4,2%) nel braccio CCRT.
La radioterapia aggiuntiva dopo il completamento della NACT-S è stata somministrata a 107 pazienti (48%).
Una chirurgia dopo chemio-radioterapia concomitante è stata effettuata in 20 pazienti (8%).
Eventi avversi a breve termine di grado 3 o superiore si sono verificati più frequentemente nel braccio trattato con NACT-S (41% vs 23%).
Eventi avversi (AE) a lungo termine di grado 3 o superiore si sono verificati più frequentemente nel braccio di pazienti trattati con chemio-radioterapia concomitante (CCR) (21% vs 15%).
La Sopravvivenza Globale a 5 anni nella ITT (intention-to-treat) population * – end point primario dello studio- non è risultata significativamente diversa tra NACT-S (72%; 95% CI,66-77) e CCRT (76%; 95% CI, 70-80) ( 95% CI 4-11; p=0,291).
CONCLUSIONI
Questo studio non ha dimostrato la superiorità in Sopravvivenza Globale a 5 anni del braccio NACT-S rispetto al braccio chemio-radioterapia concomitante ma ha evidenziato una morbidità e una Qualità di vita (QofL) accettabili in entrambi i gruppi.
* Intention-to-treat population analysis: tutti i pazienti randomizzati sono stati analizzati nel braccio a cui sono stati assegnati dalla randomizzazione.
COMMENTO
Questo studio randomizzato di fase III, multicentrico, che ha arruolato 626 pazienti in un lungo periodo di tempo, non ha dimostrato una superiorità in sopravvivenza globale a 5 anni del trattamento chemioterapia neoadiuvanteà chirurgia rispetto alla chemio-radioterapia concomitante.
Ha evidenziato una morbidità e una QofL accettabile in entrambi i bracci di trattamento.
Da segnalare che la radioterapia aggiuntiva è stata somministrata al 48% delle pazienti assegnate al braccio di trattamento con chemioterapia neoadiuvanteà chirurgia, dopo il termine di questo trattamento.
La chemio-radioterapia concomitante rimane il trattamento standard nel carcinoma della cervice stadio IB2-IIA2-IIB.
BIBLIOGRAFIA
Sardi JE, Sananes CE, Giaroli AA, et al: Neoadjuvant chemotherapy in cervical carcinoma stage IIB: A randomized controlled trial. Int J Gyn Cancer 8:441-450, 1998
Benedetti-Panici P, Greggi S, Colombo A, et al: Neoadjuvant chemotherapy and radical surgery versus exclusive radiotherapy in locally advanced squamous cell cervical cancer: Results from the Italian multicenter randomized study. J Clin Oncol 20:179-188, 2002
McNeil C: New standard of care for cervical cancer sets stage for next questions. J Natl Cancer Inst 91:500-501, 1999
Neoadjuvant Chemotherapy for Cervical Cancer Meta-Analysis Collaboration (NACCCMA) Collaboration: Neoadjuvant chemotherapy for locally advanced cervix cancer. Cochrane Database Syst Rev 2004:CD001774, 2004
Prat J; FIGO Committee on Gynecologic Oncology: Staging classification for cancer of the ovary, fallopian tube, and peritoneum. Int J Gynaecol Obstet 124:1-5, 2014


