
OSIMERTINIB AFTER CHEMORADIOTHERAPY IN STAGE III EGFR-MUTATED NSCLC
Shun Lu, M.D., Terufumi Kato, M.D., Xiaorong Dong, M.D., Ph.D., Myung-Ju Ahn, M.D., Le-Van Quang, M.D., Nopadol Soparattanapaisarn, M.D., Takako Inoue, M.D., Chih-Liang Wang, M.D., Meijuan Huang, M.D., James Chih-Hsin Yang, M.D., Ph.D., Manuel Cobo, M.D., Mustafa Özgüroğlu, M.D., Ignacio Casarini, M.D., Dang-Van Khiem, M.D., Virote Sriuranpong, M.D., Ph.D., Eduardo Cronemberger, M.D., Toshiaki Takahashi, M.D., Ph.D., Yotsawaj Runglodvatana, M.D., Ming Chen, M.D., Ph.D., Xiangning Huang, Ph.D., Ellie Grainger, M.Sc., Dana Ghiorghiu, M.D., Ph.D., Toon van der Gronde, Pharm.D., Ph.D., and Suresh S. Ramalingam, M.D., for the LAURA Trial Investigators*
N Engl J Med. 2024 Jun doi: 10.1056/NEJMoa2402614.
Dal 20% al 30% dei pazienti con carcinoma polmonare non a piccole cellule (NSCLC) si presenta alla diagnosi come malattia localmente avanzata stadio III: di questi pazienti, dal 60% al 90% hanno una malattia considerata NON resecabile. Mutazioni di EGFR sono riportate fino al 30% dei pazienti con malattia stadio III non resecabile che ricevono chemioradioterapia definitiva: per questi pazienti non sono al momento disponibili terapie a bersaglio molecolare approvate. Alcuni studi hanno evidenziato risultati promettenti con inibitori tirosinchinasici di EGFR in pazienti con NSCLC stadio III non resecabile e mutazioni EGFR ( Kato T et al, 2024; Xing L et al, 2021).
METODI
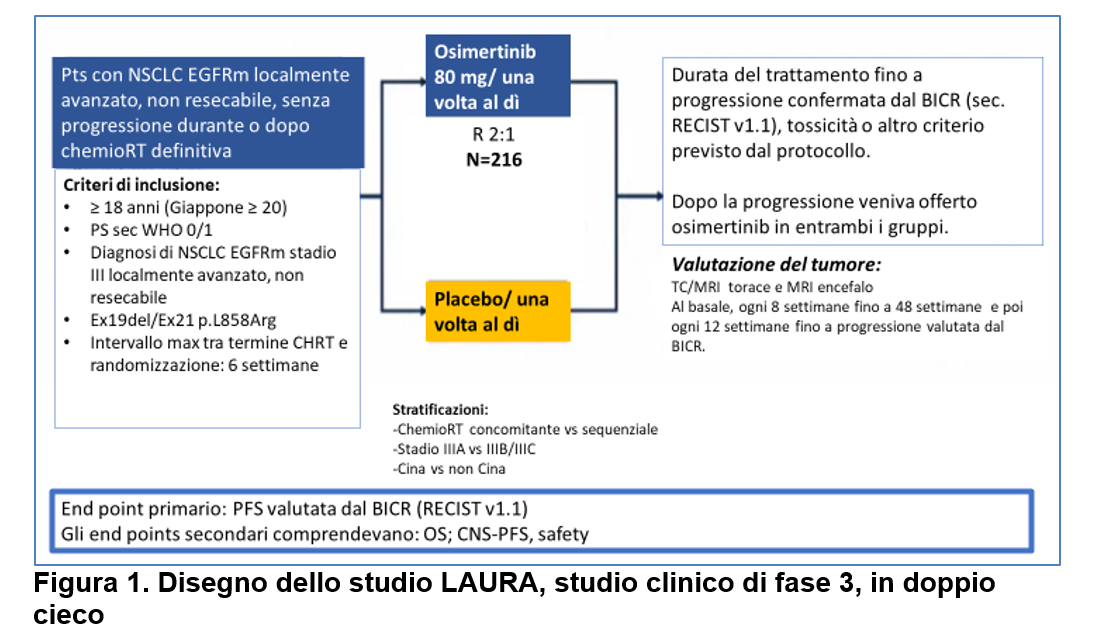
In questo studio di fase 3, in doppio cieco, placebo-controllato, sono stati arruolati pazienti con NSCLC stadio III (secondo 8a edizione AJCC), non resecabile e con mutazione EGFR a livello dell’esone 19 (delezione) o dell’esone 21 (p.Leu858Arg). I pazienti dovevano aver completato chemioterapia (contenente platino) e Radioterapia (concomitante o sequenziale) nelle 6 settimane precedenti la randomizzazione, senza progressione di malattia durante o dopo la chemioradioterapia (CT-RT) definitiva.
Non erano elegibili pazienti con storia di malattia polmonare interstiziale prima della CT-RT, con polmonite asintomatica dopo CT-RT o con effetti collaterali di grado ≥2 da CT-RT non risolti.
I pazienti sono stati randomizzati a ricevere osimertinib o placebo fino alla progressione di malattia (valutata da una revisione centrale indipendente in cieco=BICR), tossicità o altro criterio previsto dal protocollo (Figura 1). Quindi la durata di osimertinib non era prefissata e non era limitata nel tempo.
Inoltre, il protocollo di studio prevedeva per i pazienti del gruppo placebo, al momento della progressione di malattia confermata dal BICR, la possibilità di iniziare osimertinib.
L’end point primario era la sopravvivenza libera da progressione, valutata da una revisione centrale indipendente in cieco (BICR) secondo RECIST v1.1.
La PFS è stata definita come il tempo intercorso tra randomizzazione e progressione di malattia o morte per qualsiasi causa in assenza di progressione.
Tra gli endpoint secondari, la sopravvivenza globale, la sopravvivenza libera da progressione a livello del SNC, il tasso di risposte obiettive, la durata della risposta, la QofL e la tossicità (graduata secondo CTCAE v 5.0).
RISULTATI
Dall’agosto 2018 al Luglio 2022, un totale di 216 pazienti trattati con chemio-radioterapia (CH-RT) sono stati randomizzati (2:1) a ricevere osimertinib (=143 pazienti) oppure placebo (=73 pazienti).
La maggior parte dei pazienti arruolati erano asiatici. La maggior parte dei pazienti era stata trattata con chemio-radioterapia concomitante.
Al momento dell’analisi primaria della PFS si erano verificati 120 eventi (come previsto dall’analisi statistica): 57 eventi nel gruppo osimertinib e 63 nel gruppo placebo.
Osimertinib ha determinato un significativo beneficio in termini di sopravvivenza libera da progressione rispetto al placebo: la sopravvivenza mediana libera da progressione è stata di 39,1 mesi (95% CI 31,5-non calcolabile) con osimertinib rispetto a 5,6 mesi (95% CI 3,7-7,4) con placebo. L’ hazard ratio per la progressione di malattia o morte è stato pari a 0,16 (95% CI 0,10-0,24; p<0,001) (Figura 2).
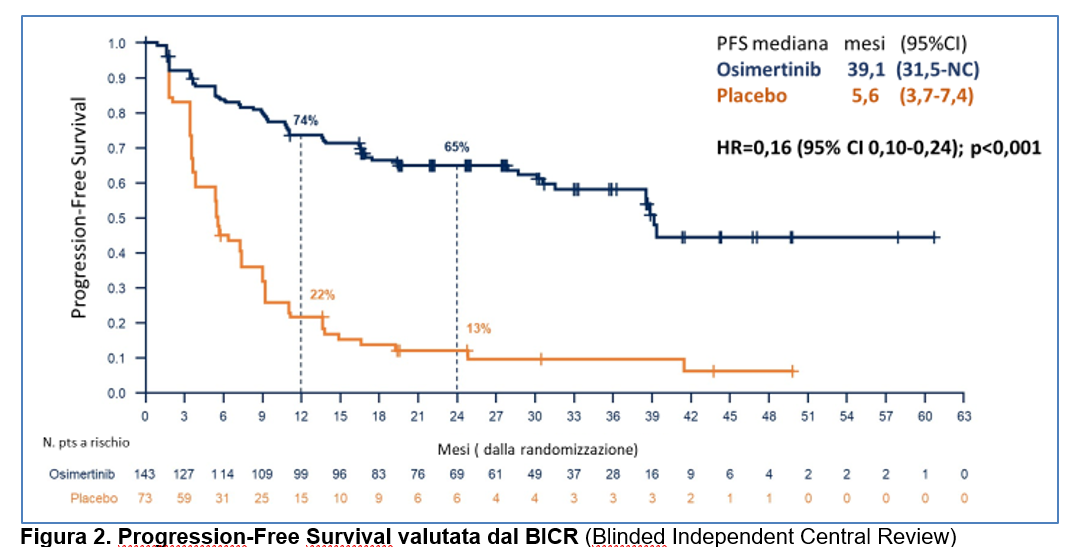
La percentuale di pazienti vivi e liberi da progressione a 12 mesi è stata del 74% (95% CI, 65-80) con osimertinib e del 22% (95% CI, 13-32) con il placebo; a 24 mesi è stata del 65% (95% CI 56-73) con osimertinib e del 13% (95% CI 6-22) con placebo (Figura 2).
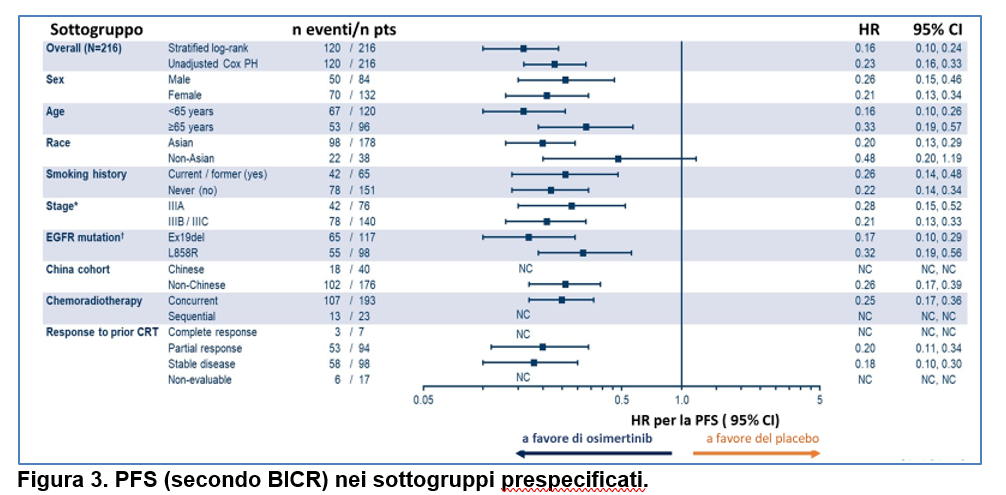
Il vantaggio in PFS con osimertinib è stato osservato in tutti i sottogruppi prespecificati ( Figura 3).
Alla data dell’analisi ad interim, erano deceduti 43 pazienti (maturità dei dati: 20%).
La sopravvivenza globale a 36 mesi è stata dell’84% nei pazienti del gruppo osimertinib
(95% CI, 75-89) e del 74% nei pazienti del gruppo placebo (95% CI, 57-85), con un
hazard ratio per morte pari a 0,81 (95% CI, 0,42-1,56); p=0,53).
Va considerato che nel gruppo placebo, l’81% dei pazienti con progressione di malattia confermata dal BIRC ha eseguito cross-over a osimertinib.
L’analisi finale della Sopravvivenza globale è prevista al 60% di maturità dei dati (quando si saranno verificati approssimativamente 120 decessi).
L’incidenza di eventi avversi di grado ≥3 è stata del 35% nel gruppo osimertinib e del 12% nel gruppo placebo; la polmonite da radiazioni (per lo più di grado 1-2) è stata riportata nel 48% e nel 38% dei casi, rispettivamente. Non sono emerse nuove tossicità.
CONCLUSIONI
Il trattamento con osimertinib ha determinato una sopravvivenza libera da progressione significativamente più lunga rispetto al placebo nei pazienti con NSCLC stadio III non resecabile con mutazione di EGFR.
I risultati dello studio LAURA sono stati presentati all’ASCO 2024 da Ramalingam SS et al e sono stati contemporaneamente pubblicati nel NEJM .
Per ulteriori approfondimenti, collegarsi al video del POST-CHICAGO 2024 di AIGOM ed ascoltare la relazione del Dr Ettore d’Argento:
https://www.aigom.it/2024/06/18/le-novita-da-chicago-2024-17-giugno-2024-ore-15-00-18-00/
BIBLIOGRAFIA
Kato T, Casarini I, Cobo M, et al. Targeted treatment for unresectable EGFR mutation-positive stage III non-small cell lung cancer: emerging evidence and future perspectives. Lung Cancer 2024;187: 107414.
Xing L, Wu G, Wang L, et al. Erlotinib versus etoposide/cisplatin with radiation therapy in unresectable stage III epidermal growth factor receptor mutationpositive non-small cell lung cancer: a multicenter, randomized, open-label, phase 2 trial. Int J Radiat Oncol Biol Phys 2021; 109:1349-58.
Ramalingam SS, Kato T, Dong X, et al. Osimertinib after definitive chemoradiotherapy in patients with unresectable stage III epidermal growth factor receptor-mutated (EGFRm) NSCLC: primary resuls of the Phase 3 LAURA study. ASCO 2024; LB04.
Link all’abstract


