
OVERALL SURVIVAL IN PATIENTS WITH ENDOMETRIAL CANCER TREATED WITH DOSTARLIMAB PLUS CARBOPLATIN-PACLITAXEL IN THE RANDOMIZED ENGOT-EN6/GOG-3031/RUBY TRIAL
Powell MA, Bjørge L, Willmott L, Novák Z, Black D, Gilbert L, Sharma S, Valabrega G, Landrum LM, Gropp-Meier M, Stuckey A, Boere I, Gold MA, Segev Y, Gill SE, Gennigens C, Sebastianelli A, Shahin MS, Pothuri B, Monk BJ, Buscema J, Coleman RL, Slomovitz BM, Ring KL, Herzog TJ, Balas MM, Grimshaw M, Stevens S, Lai DW, McCourt C, Mirza MR.
Ann Oncol. 2024 Jun 10:S0923-7534(24)00721-X. doi: 10.1016/j.annonc.2024.05.546. Epub ahead of print. PMID: 38866180.
Free article
———
Dal 6 marzo 2024 è attivo in Italia l’Expanded Access Program (EAP) di dostarlimab in associazione a carboplatino e paclitaxel per il trattamento di pazienti adulte affette da cancro endometriale (CE) primario avanzato o ricorrente con deficit del sistema di mismatch repair (dMMR)/elevata instabilità dei microsatelliti (MSI-H) e che sono candidate a terapia sistemica.
https://www.aigom.it/2024/04/15/dostarlimab-for-primary-advanced-or-recurrent-endometrial-cancer/
———–
Il carcinoma dell’endometrio rappresenta la seconda più frequente neoplasia ginecologica nel mondo, con tassi di incidenza e mortalità in aumento.
Il trattamento standard di prima linea per il carcinoma dell’endometrio avanzato alla diagnosi o in ripresa è stata la chemioterapia con carboplatino e paclitaxel, ma con sopravvivenza mediana inferiore a 3 anni.
Lo studio RUBY di fase 3-PARTE 1- ha valutato dostarlimab+ chemioterapia ( carboplatino e paclitaxel) rispetto a placebo + chemioterapia (carboplatino e paclitaxel)
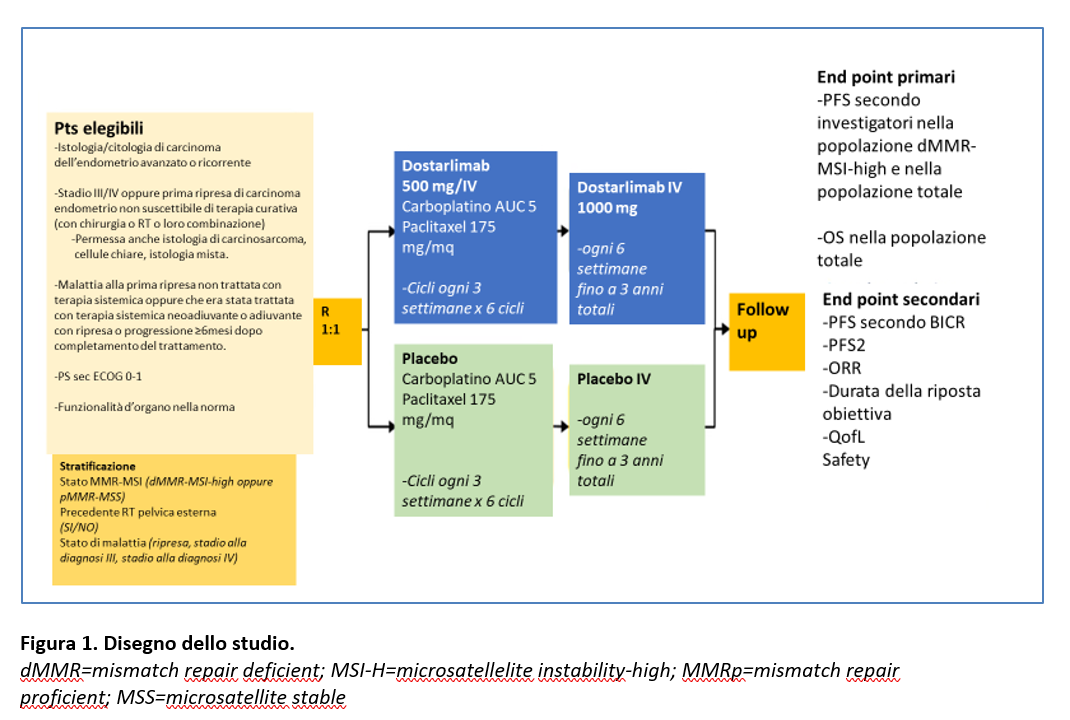
I pazienti arruolati dovevano avere ≥ 18 anni d’età e un cancro dell’endometrio avanzato alla diagnosi (FIG0 stadio III-IV) o in ripresa NON suscettibile di essere trattato con sola Radioterapia o chirurgia o entrambe, istologicamente o citologicamente confermato. Altri criteri di eligibilità richiesti sono riportati nella Figura 1.
Inoltre, veniva richiesto materiale tumorale sufficiente per la valutazione dello stato del mismatch repair e dei microsatelliti.
Nello studio RUBY i pazienti sono stati randomizzati (1:1) a ricevere dostarlimab (500 mg/IV) oppure placebo in combinazione con carboplatino (AUC5/IV) + paclitaxel (175 mg/mq/IV) ogni 3 settimane per 6 cicli, seguiti da terapia di mantenimento con dostarlimab (1000 mg/IV) o placebo ogni 6 settimane fino a 3 anni oppure fino a progressione di malattia, interruzione per tossicità, ritiro del consenso, decisione dell’investigatore o morte.
I pazienti venivano stratificati per stato di MMR-MSI, precedente radioterapia pelvica e stadio di malattia (Figura 1).
Gli endpoint primari erano:
- PFS valutata dai ricercatori (sec. RECIST v 1.1) nella popolazione dMMR/MSI-H e nella popolazione globale (valutata in maniera gerarchica prima nella popolazione dMMR/MSI-H e poi nella popolazione globale);
- OS nella popolazione globale.
RISULTATI ALLA PRIMA ANALISI AD INTERIM( IA1)
Da Giugno 2019 a Febbraio 2021, sono stati randomizzate 494 pazienti: 245 al gruppo dostarlimab + carboplatino e paclitaxel (CP) e 249 al gruppo placebo + CP. Circa il 25% dei pazienti arruolati aveva uno stato dMMR-MSI-H (21,6% nel gruppo dostarlimab e 26,1% nel gruppo placebo), con percentuali simili a quelle riportate in letteratura.
Al momento della prima analisi ad interim -IA1- (data del cutoff: 28 settembre 2022) (Mirza MR et al, 2023), è stata osservata una PFS statisticamente superiore con dostarlimab sia nella popolazione dMMR/MSI-H ( HR=0,28; 95% CI 0,16-0,50; p < 0,001) che nella popolazione globale ( HR=0,64; 95% CI 0,51-0,80; p < 0,001) (Figura 2) ( Mirza MR et al, 2023). Invece la sopravvivenza globale popolazione globale non aveva incrociato il limite statistico prefissato (p= 0,00177).
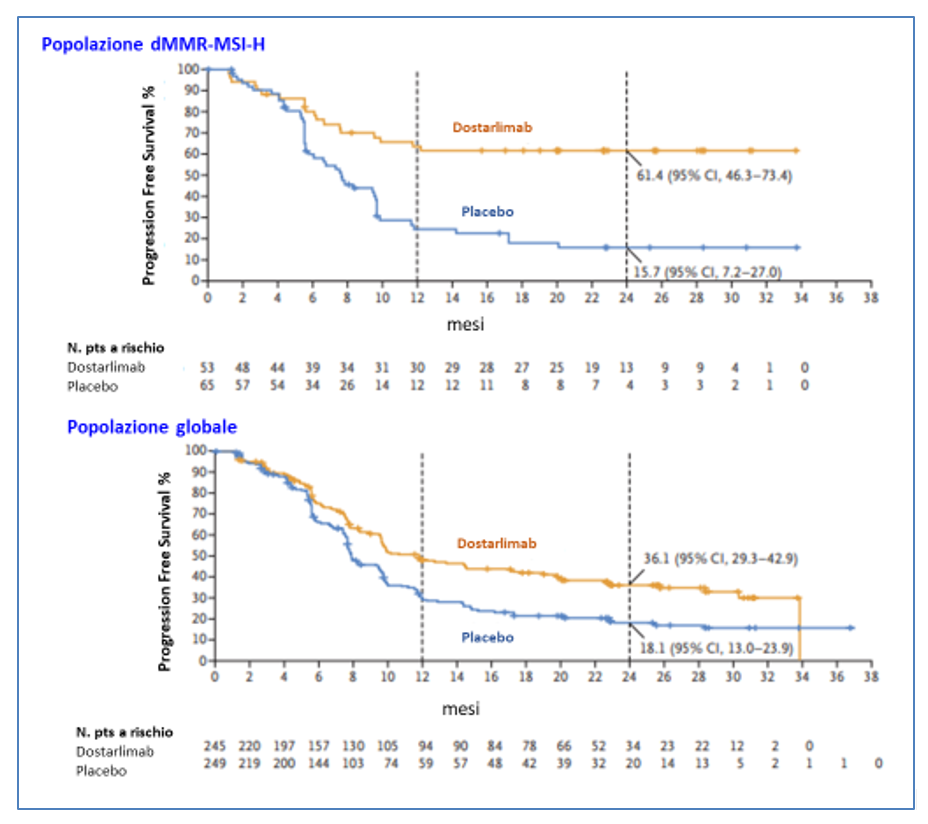

Sulla base dei riultati della PFS alla prima analisi ad interim, dostarlimab è stato approvato in molti Paesi come prima linea per pazienti adulti con cancro dell’endometrio dMMR/MSI-H.
RISULTATI ALLA SECONDA ANALISI AD INTERIM (IA2)
Alla data del cutoff per la seconda analisi ad interim (22 Settembre 2023) 27 pazienti (11%) stavano ancora ricevendo dostarlimab e 22 pazienti (8,8%) placebo. La durata mediana del follow up è stata di circa 37 mesi.
Poiché la PFS aveva incrociato la soglia prefissata sia nella popolazione dMMR-MSI-H che nella popolazione globale al momento della prima analisi ad interim, la PFS non è stata rivalutata alla seconda analòisi ad interim.
In questa seconda analisi ad interim sono riportati i dati aggiornati della sopravvivenza globale nella popolazione globale (altro endpoint primario), della PFS2 e della safety.
Sopravvivenza globale
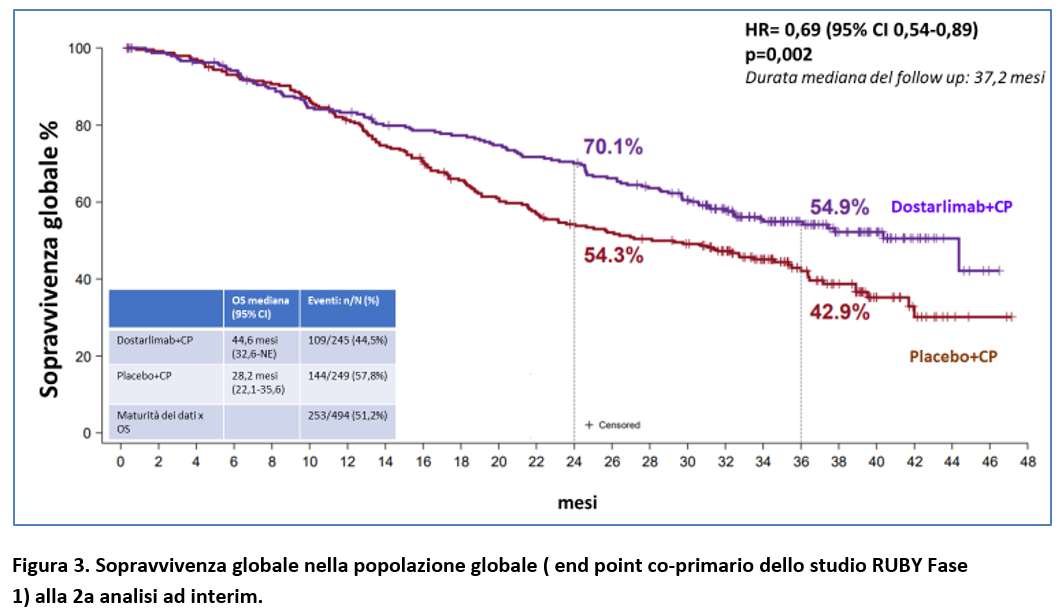
Alla seconda analisi ad interim, (253 decessi) lo studio RUBY-PARTE 1- ha evidenziato una sopravvivenza globale nella popolazione globale (endpoint co-primario) statisticamente superiore con dostarlimab + CP rispetto a placebo+CP (Figura 3), con una OS mediana di 44,6 mesi vs 28,2 mesi e una differenza di 16,4 mesi.
La riduzione del rischio di morte è risultato essere statisticamente significativa con l’aggiunta di dostarlimab vs placebo, con un HR = 0,69; 95% CI 0,54-0,89; p = 0,0020.
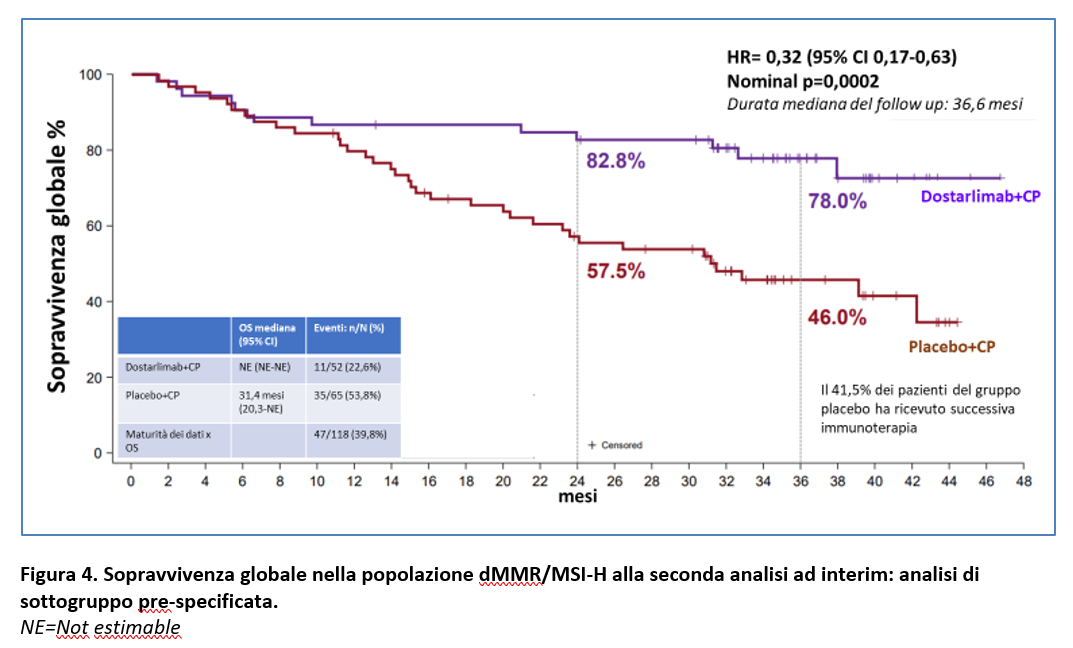
Il vantaggio in OS derivante dall’aggiunta di dostarlimab alla chemioterapia (CP) è stato riportato nelle analisi esploratorie prespecificate sia nella popolazione dMMR/MSI-H (OS mediana non raggiunta nel gruppo Dostarlimab vs 31,4 mesi nel gruppo placebo; HR=0,32 (95% CI; 0,17-0,63) nominal p=0,0002) (Figura 4) sia nella popolazione MMRp/MSS (OS mediana non raggiunta nel gruppo Dostarlimab vs 27 mesi nel gruppo placebo; HR=0,79; 95% CI 0,60-1,04; nominal p=0,0493) (Figura 5).
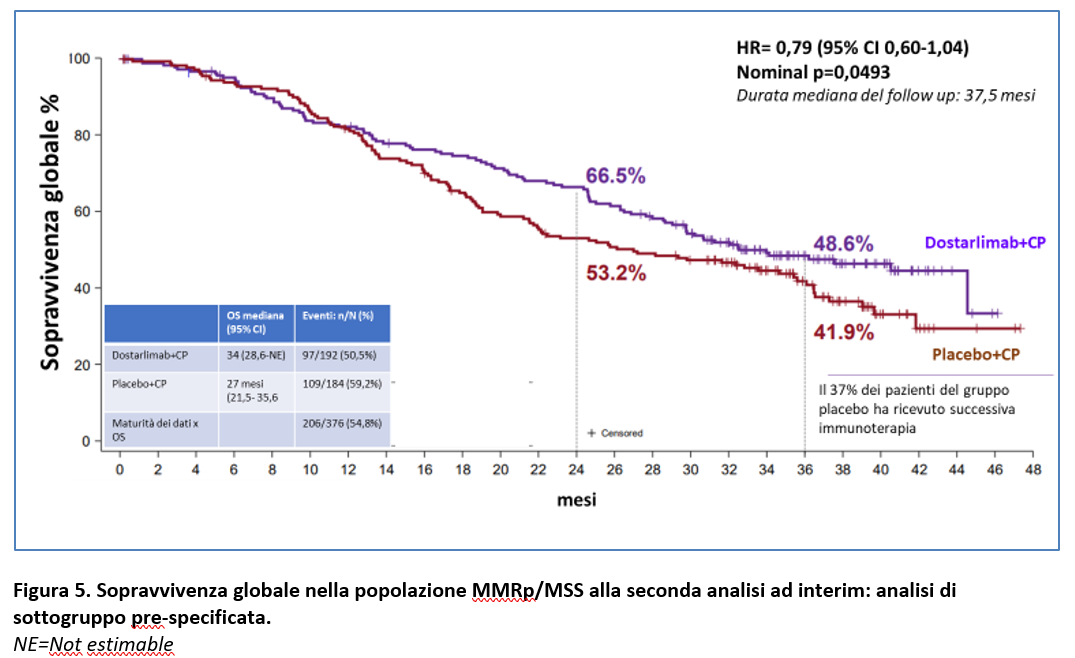
Il beneficio con dostarlimab+CP è stato consistente nella maggior parte dei sottogruppi prespecificati.
TERAPIE SUCCESSIVE
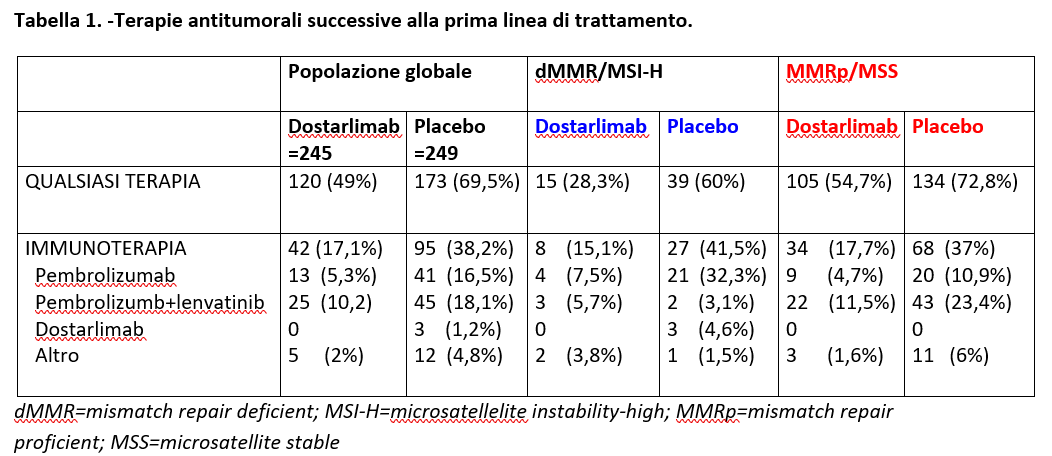
Nella popolazione globale, 173 dei 249 pazienti (69,5%) trattati con placebo+CP e 120 dei 245 pazienti (49%) trattati con dostarlimab, hanno ricevuto una terapia antitumorale successiva. Il 54,9% dei pazienti del gruppo placebo ha ricevuto successivamente immunoterapia vs 35% dei pazienti del gruppo dostarlimab: la combinazione più frequentemente somministrata è stata pembrolizumab+lenvatinib (Tabella 1.).
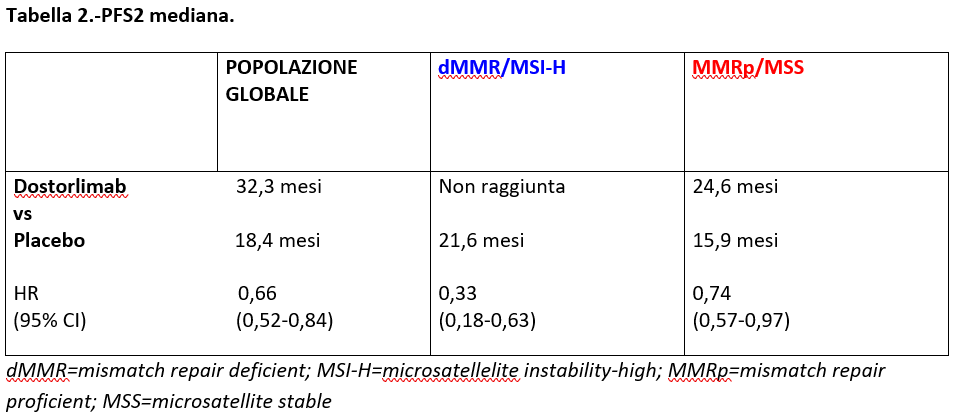
PROGRESSION-FREE SURVIVAL 2 (PFS2)
La Progression-Free survival 2 (PFS2) è stata definita come l’intervallo di tempo intercorso tra la randomizzazione e la data della progressione alla terapia successiva allo schema valutato in questo studio o alla morte per qualsiasi causa.
A questa seconda analisi ad interim, l’aggiunta di Dostarlimab a CP ha ridotto il rischio di progressione o morte dopo l’inizio di una successiva terapia nella popolazione globale, dMMR/MSI-H e MMRp/MSS.
SAFETY
Gli eventi avversi sono stati valutati secondo CTCAE v.4.
La durata mediana del trattamento a questa seconda analisi ad interim è stata di 43 settimane nel gruppo dostarlimab (range, 3-192, 6 settimane) e 36 settimane nel gruppo placebo (2,1-193, 1 settimana).
Il profilo di tossicità del dostarlimab è stato sovrapponibile a quello osservato nella prima analisi ad interim.
CONCLUSIONI
A questa seconda analisi ad interim prespecificata dal protocollo, con una durata mediana del follow up di 37,2 mesi, lo studio RUBY-PARTE 1- ha evidenziato un vantaggio statisticamente significativo e clinicamente rilevante in OS nella popolazione globale derivante dall’aggiunta del dostarlimab a CP vs placebo.
Alle analisi esploratorie prespecificate, il vantaggio in OS è stato riportato anche nella popolazione dMMR/MSI-H e nella popolazione MMRp/MSS.
COMMENTO
Dal 6 marzo 2024 è attivo in Italia l’Expanded Access Program (EAP) di dostarlimab in associazione a carboplatino e paclitaxel per il trattamento di pazienti adulte affette da cancro endometriale (CE) primario avanzato o ricorrente con deficit del sistema di mismatch repair (dMMR)/elevata instabilità dei microsatelliti (MSI-H) e che sono candidate a terapia sistemica.
https://www.aigom.it/2024/04/15/dostarlimab-for-primary-advanced-or-recurrent-endometrial-cancer/
BIBLIOGRAFIA
Mirza MR, Chase DM, Slomovitz BM, dePont Christensen R, Novák Z, Black D, Gilbert L, Sharma S, Valabrega G, Landrum LM, Hanker LC, Stuckey A, Boere I, Gold MA, Auranen A, Pothuri B, Cibula D, McCourt C, Raspagliesi F, Shahin MS, Gill SE, Monk BJ, Buscema J, Herzog TJ, Copeland LJ, Tian M, He Z, Stevens S, Zografos E, Coleman RL, Powell MA; RUBY Investigators. Dostarlimab for Primary Advanced or Recurrent Endometrial Cancer. N Engl J Med. 2023 Jun 8;388(23):2145-2158. doi: 10.1056/NEJMoa2216334. Epub 2023 Mar 27. PMID: 36972026.
Powell MA et al. Overall survival in patients with primary advanced or recurrent endometrial cancer treated with dostarlimab plus chemotherapy in Part 1 of the ENGOT-EN6-NSGO/GOG-3031/RUBY trial. SGO 2024
Link all’abstract:
https://pubmed.ncbi.nlm.nih.gov/38866180/
09/07/2024


