PEMBROLIZUMAB AND CHEMOTHERAPY IN HIGH-RISK, EARLY-STAGE, ER+/HER2-BREAST CANCER: A RANDOMIZED PHASE 3 TRIAL.
Cardoso F, O’Shaughnessy J, Liu Z, McArthur H, Schmid P, Cortes J, Harbeck N, Telli ML, Cescon DW, Fasching PA, Shao Z, Loirat D, Park YH, Fernandez MG, Rubovszky G, Spring L, Im SA, Hui R, Takano T, André F, Yasojima H, Ding Y, Jia L, Karantza V, Tryfonidis K, Bardia A.
Nat Med. 2025 Feb;31(2):442-448. doi: 10.1038/s41591-024-03415-7.
Link all’abstract
https://pubmed.ncbi.nlm.nih.gov/39838117/
L’aggiunta di pembrolizumab alla chemioterapia neoadiuvante, seguita da pembrolizumab adiuvante, ha migliorato l’outcome dei pazienti con carcinoma mammario triplo negativo in stadio iniziale ad alto rischio. Tuttavia, non è ancora chiaro se l’aggiunta di pembrolizumab neoadiuvante alla chemioterapia possa essere di beneficio nei pazienti con carcinoma mammario ER+/HER2 negativo in stadio iniziale ad alto rischio.
Il carcinoma della mammella ER+/HER2 negativo è una malattia eterogenea che include una sottopopolazione di pazienti ad alto rischio di recidiva con scarso outcome a lungo termine nonostante la chemioterapia (neo)adiuvante e la terapia ormonale adiuvante. Per i pazienti ad alto rischio, i tassi di risposte patologiche complete (pCR) riportati oscillano dallo 0% al 18%, con tassi di sopravvivenza libera da eventi simili alle pazienti con carcinoma triplo negativo.
La combinazione di inibitori del checkpoint immunitario + chemioterapia induce dei cambiamenti nel micro-ambiente tumorale che potrebbero potenziare la risposta immunitaria endogena contro le cellule tumorali, ridurre il volume tumorale e aumentare i tassi di risposta rispetto alla chemioterapia. A supporto di questa ipotesi, dati clinici hanno dimostrato che Pembrolizumab (anticorpo monoclonale anti-PD-1) combinato con la chemioterapia neoadiuvante nello studio di fase 2 I-SPY2 ha raddoppiato i tassi stimati di pCR nelle pazienti affetti da carcinoma mammario ER+/HER2 negativo ad alto rischio (definiti tali secondo il Mammaprint score) rispetto a quelle che avevano ricevuto il trattamento chemioterapico (30% vs 13% rispettivamente) (1). In aggiunta, il pembrolizumab in combinazione con il trattamento chemioterapico ha mostrato un aumento dei tassi di pCR e EFS nei pazienti affetti da TNBC in stadio precoce (2), (3).
Sulla base di tali premesse, lo studio KEYNOTE-756, uno studio randomizzato, in doppio cieco, di fase 3, è stato disegnato per valutare l’efficacia e la sicurezza dell’aggiunta del pembrolizumab alla chemioterapia neoadiuvante in pazienti con carcinoma mammario infiltrante ER+/HER2 negativo ad alto rischio (identificativo ClinicalTrials.gov: NCT03725059).
METODI
Pazienti
I pazienti eleggibili avevano un’età ≥18 anni con nuova diagnosi di carcinoma duttale invasivo ER+/HER2 negativo di grado 3 confermato centralmente, non precedentemente trattato e non metastatico, stadio clinico cT1c–2 (≥2 cm) cN1–2 oppure T3–4 cN0–2), PS sec ECOG ≤1, e una funzione d’organo adeguata.
Erano elegibili anche i pazienti con tumori primari multifocali, carcinoma mammario infiammatorio e quelli con bassa positività per il recettore degli estrogeni.
I criteri di esclusione includevano: carcinoma mammario bilaterale, multicentrico, lobulare o metastatico; malattia autoimmune per la quale il paziente era stato trattato con terapia sistemica negli ultimi 2 anni; diagnosi di immunodeficienza o uso di terapia immunosoppressiva nell’ultima settimana; storia di polmonite non infettiva trattata con steroidi; polmonite; tubercolosi attiva; infezione attiva per la quale il paziente stava ricevendo terapia sistemica; malattia cardiovascolare clinicamente significativa.
Disegno dello studio e trattamento
Il KEYNOTE-756 è uno studio di fase 3, randomizzato, in doppio cieco, in cui i pazienti hanno ricevuto il trattamento nelle fasi neoadiuvante e adiuvante. Non era consentito il crossover tra i gruppi di trattamento.
I pazienti sono stati assegnati in modo randomizzato (rapporto 1:1) al gruppo pembrolizumab + chemioterapia o al gruppo placebo + chemioterapia.
I pazienti del gruppo pembrolizumab + chemioterapia hanno ricevuto quattro cicli di pembrolizumab (200 mg e.v. ogni 3 settimane) in combinazione con paclitaxel settimanale (80 mg/m²)- prima parte della terapia neoadiuvante- seguiti da quattro cicli di pembrolizumab in combinazione con doxorubicina (60 mg/m²) o epirubicina (100 mg/m²) più ciclofosfamide (600 mg/m²), somministrati ogni 2 settimane o ogni 3 settimane -seconda parte della terapia neoadiuvante-.

L’intervento chirurgico (conservazione della mammella o mastectomia, con/senza biopsia del linfonodo sentinella o dissezione ascellare) doveva avvenire entro 6 settimane dall’ultima dose del trattamento neoadiuvante.
I pazienti dell’Europa orientale sono stati ulteriormente stratificati in base allo stato del PD-L1 tumorale (CPS ≥1 vs <1). I pazienti cinesi non sono stati ulteriormente stratificati. I pazienti di tutti gli altri Paesi (esclusa l’Europa orientale e la Cina) sono stati ulteriormente stratificati in base a:
- Stato del PD-L1 tumorale (CPS ≥1 vs <1)
- Coinvolgimento linfonodale (positivo vs negativo)
- Schedula di somministrazione delle antracicline (ogni 2 settimane vs ogni 3 settimane)
- Positività di ER (≥10% vs <10%)
I pazienti sono stati stratificati al momento della randomizzazione in base alla regione (Europa orientale, Cina o tutti gli altri Paesi) per garantire un equilibrio tra i gruppi di trattamento.
Nella fase adiuvante i pazienti (entro 60 giorni dalla data dell’intervento chirurgico) hanno ricevuto pembrolizumab o placebo ogni 3 settimane per 9 cicli (6 mesi) in aggiunta alla terapia ormonale a scelta dello sperimentatore (durata di 10 anni). La terapia adiuvante con abemaciclib non era consentita. La radioterapia adiuvante era consentita, prima o in concomitanza con la terapia adiuvante.
Il trattamento veniva interrotto nei pazienti con progressione o recidiva di malattia, o tossicità inaccettabile.
End Point
Gli endpoint primari dello studio erano due:
- la pCR nella intention-to-treat (ITT) population, definita secondo i criteri AJCC (ypT0/Tis ypN0) al momento della chirurgia e valutata da un patologo locale in cieco rispetto al trattamento eseguito;
- la EFS (sopravvivenza libera da eventi) definita come il tempo dalla randomizzazione alla progressione di malattia, recidiva locale o a distanza, un secondo tumore primario o la morte per qualsiasi causa nella ITT population, valutata in cieco dall’investigatore.
Gli endpoint secondari includevano:
- pCR in tutti i pazienti definita come ypT0/Tis ypN0;
- pCR nei pazienti con PD-L1 CPS ≥ 1;
- EFS nei pazienti con PD-L1 CPS ≥ 1;
- OS (overall survival, sopravvivenza globale) in tutti i pazienti e nei pazienti con PD-L1 CPS ≥ 1;
- sicurezza nelle fasi neoadiuvante e adiuvante in tutti i pazienti che hanno ricevuto almeno 1 somministrazione della terapia dello studio, o sono stati operati o entrambi.
La valutazione della malattia residua (RCB, Residual Cancer Burden) a livello mammario o linfonodale al momento dell’intervento chirurgico era un endpoint esploratorio e veniva graduata come riportato:
- RCB-0: residuo tumorale assente
- RCB-I: residuo tumorale minimo
- RCB-II: residuo tumorale moderato
- RCB-III: residuo tumorale elevato
(calcolatore RCB https://www3.mdanderson.org/app/medcalc/index.cfm?pagename=jsconvert3 )
RISULTATI
Pazienti e trattamento
Dal 27 dicembre 2018 al 5 agosto 2022, sono stati inclusi, in 222 centri, 1.278 pazienti. I pazienti sono stati randomizati (1:1) al braccio pembrolizumab + chemioterapia (635 pazienti) o al braccio placebo + chemioterapia (643 pazienti). Le caratteristiche demografiche e della malattia erano bilanciate tra i due gruppi di trattamento.
Alla prima analisi ad interim (data di cutoff: 25 maggio 2023; durata mediana del follow-up: 33,2 mesi), 1.275 pazienti avevano ricevuto il primo trattamento neoadiuvante, 1.210 pazienti avevano iniziato il secondo trattamento neoadiuvante, 1.245 pazienti avevano eseguito l’intervento chirurgico e 1.002 pazienti avevano iniziato il trattamento adiuvante.
La durata mediana del trattamento nella fase neoadiuvante è stata di 4,9 mesi (intervallo = 0,0–6,9 mesi) nel braccio pembrolizumab + chemioterapia e di 4,9 mesi (intervallo = 0,0–7,8 mesi) nel braccio placebo + chemioterapia. Entrambi i gruppi hanno ricevuto un numero mediano simile di cicli di chemioterapia.
Efficacia
È stata osservata una pCR (ypT0/Tis ypN0) in 154 dei 635 pazienti (24,3%) nel braccio pembrolizumab + chemioterapia e in 100 dei 643 pazienti (15,6%) nel braccio placebo + chemioterapia, con un delta di 8,5% (95% CI 4,2–12,8; p = 0,00005) (Figura 2).

I benefici in termini di pCR con pembro+chemioterapia rispetto a placebo+chemioterapia sono stati consistenti in tutti i sottogruppi considerati.
![]() Le differenze percentuali tra i pazienti trattati con pembrolizumab + chemioterapia e quelli trattati con placebo + chemioterapia nelle diverse sottopopolazioni in base al valore di PD-L1 (CPS) sono state:
Le differenze percentuali tra i pazienti trattati con pembrolizumab + chemioterapia e quelli trattati con placebo + chemioterapia nelle diverse sottopopolazioni in base al valore di PD-L1 (CPS) sono state:
4,5 % (95% CI: 0,4 a 10,1) nei tumori PD-L1 <1 (n = 307),
9,8 (95 CI: 4,4–15,2) nei tumori ≥1 (n = 971)
13,2 (CI: 4,9–21,4) nei tumori ≥10 (n = 512)
Nell’analisi post hoc, la differenza di pCR nel sottogruppo con PD-L1 (CPS) di ≥20 (n = 254) è stata del 17,4% (95% CI: 5,1–29,1) in confronto ai pazienti trattati con placebo + chemioterapia.
In particolare, i tassi di pCR nelle varie sottopopolazione sono stati i seguenti:

![]() Un beneficio in termini di pCR con pembro+chemioterapia rispetto a placebo+chemioterapia è stato osservato sia nei pazienti ER<10% che nei pazienti con tumori ER ≥10%, sebbene il beneficio sia stato maggiore in quelli con ER positività <10%.
Un beneficio in termini di pCR con pembro+chemioterapia rispetto a placebo+chemioterapia è stato osservato sia nei pazienti ER<10% che nei pazienti con tumori ER ≥10%, sebbene il beneficio sia stato maggiore in quelli con ER positività <10%.
Tra i pazienti con positività per ER <10%, è stato riportato un tasso di pCR pari al 55,9% (19 su 34 pazienti) nel braccio pembrolizumab + chemioterapia versus 30,2% (13 su 43 pazienti) nel braccio placebo + chemioterapia (differenza: 8%; 95% CI: 3,6-12,3).
Tra i pazienti con positività per ER ≥10%, la pCR è stata del 22,5% nei pazienti trattati con pembrolizumab + chemioterapia (135 su 601 pazienti) rispetto al 14,5% nei pazienti trattati con placebo + chemioterapia (87 su 600 pazienti).
L’analisi dell’endpoint esploratorio del Residual Cancer Burden (RCB) ha evidenziato che l’aggiunta di pembrolizumab alla chemioterapia neoadiuvante ha spostato un maggior numero di pazienti verso categorie di RCB più basse:
RCB-0 o RCB-1: 35,0% versus 23,6% del gruppo placebo+chemioterapia;
RCB-2: 40,8% versus 45,3% del gruppo placebo+chemioterapia;
RCB-3: 20,5% versus 28,9% del gruppo placebo+chemioterapia (Figura 3).
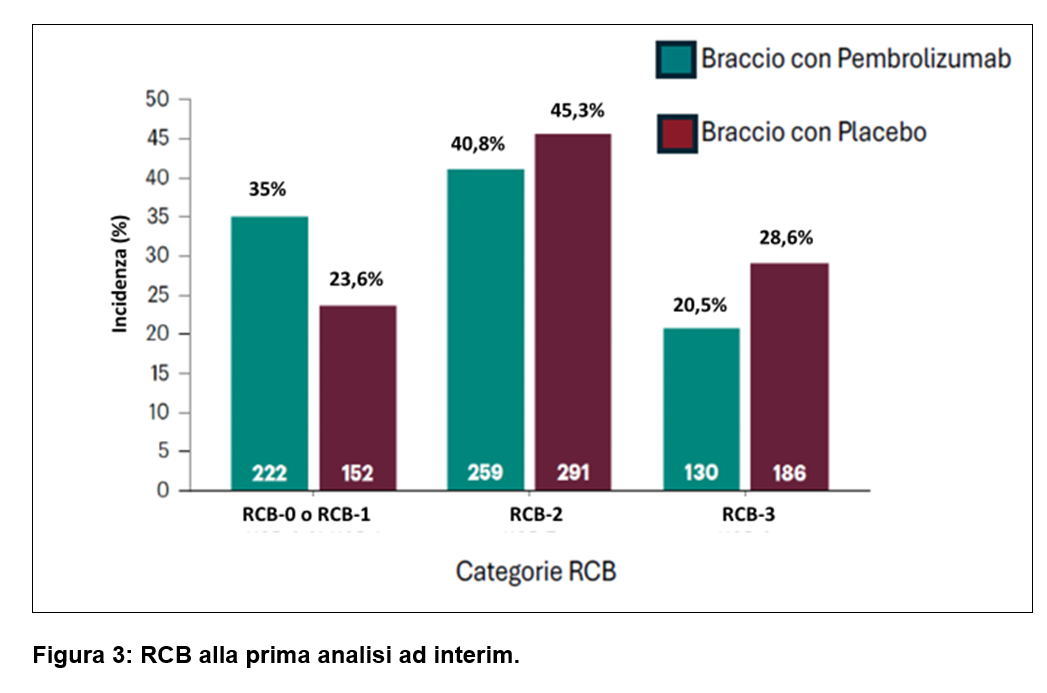
RCB era un endpoint esplorativo ed è stato valutato da un patologo locale al momento dell’intervento chirurgico. RCB-0, RCB-1, RCB-2 e RCB-3 indicano malattie residue di dimensioni progressivamente maggiori. I dati RCB erano mancanti per 24 pazienti (3,8%) nel gruppo pembrolizumab + chemioterapia e per 14 pazienti (2,2%) nel gruppo placebo + chemioterapia.
I dati di EFS non sono ancora maturi alla prima analisi ad interim.
Sicurezza
Durante la fase neoadiuvante, gli eventi avversi correlati al trattamento di qualsiasi grado si sono verificati in 624 dei 634 pazienti (98,4%) nel braccio pembrolizumab + chemioterapia e in 633 dei 642 pazienti (98,6%) nel braccio placebo + chemioterapia.
Gli eventi avversi correlati al trattamento di grado ≥3 si sono verificati in 333 pazienti (52,5%) e in 298 pazienti (46,4%), rispettivamente nel braccio pembrolizumab + chemioterapia e in quello placebo + chemioterapia.
Gli eventi avversi gravi correlati al trattamento sono stati del 18,5% e del 10,3% dei pazienti rispettivamente trattati con pembrolizumab + chemioterapia e con placebo + chemioterapia.
Un paziente (0,2%) del braccio sperimentale è deceduto a causa di un infarto miocardico acuto correlato al trattamento.
La sospensione di qualsiasi trattamento a causa di eventi avversi correlati al trattamento si è verificata in 121 pazienti (19,1%) nel braccio con pembrolizumab + chemioterapia e in 65 pazienti (10,1%) nel braccio con chemioterapia.
Gli eventi avversi correlati al trattamento più frequenti sono stati l’alopecia (64,0% e 60,9%, rispettivamente), la nausea (48,3% e 50,0%, rispettivamente), la fatigue (30,0% e 28,0%, rispettivamente) e l’anemia (32,3% e 25,5%, rispettivamente).
Gli eventi avversi immuno-relati, escluse le reazioni da infusione, di qualsiasi grado sono stati osservati in 208 pazienti (32,8%) nel braccio pembrolizumab + chemioterapia e in 45 pazienti (7,0%) nel braccio placebo + chemioterapia. Gli eventi avversi immuno-relati di grado 3/4 si sono verificati rispettivamente in 45 pazienti (7,1%) e in 8 pazienti (1,2%).
Gli eventi avversi immuno-relati più frequenti sono stati l’ipotiroidismo (17,5% e 1,7%, rispettivamente), l’ipertiroidismo (9,0% e 0,5%, rispettivamente) e la polmonite (2,8% e 1,4%, rispettivamente). Nessun decesso è stato attribuito a eventi avversi immuno-relati.
Discussione
Nello studio di fase 3 KEYNOTE-756, che includeva pazienti con carcinoma mammario in stadio precoce ad alto rischio, ER+/HER2 negativo, è stata osservata una percentuale di pCR significativamente più alta nei pazienti trattati con pembrolizumab + chemioterapia rispetto ai pazienti trattati con placebo + chemioterapia: 24,3% vs 15,6%.
La differenza di pCR tra i due gruppi ha favorito il braccio pembrolizumab + chemioterapia in tutti i sottogruppi prepianificati. In particolare, la pCR era più alta nei sottogruppi di pazienti con una maggiore espressione tumorale di PD-L1 e nel sottogruppo di pazienti con positività per ER <10%. Tuttavia, questi risultati devono essere interpretati con cautela poiché i sottogruppi erano sottorappresentati, e sono necessarie ulteriori studi per rafforzare questa tendenza positiva.
L’aggiunta di pembrolizumab alla chemioterapia neoadiuvante ha anche spostato un maggior numero di pazienti verso categorie di RCB più basse (RCB-0 e RCB-1), mostrando un’azione di riduzione delle dimensioni del residuo tumorale.
I risultati dello studio sono coerenti con quelli dello studio di fase 2 I-SPY2 (1), in cui l’aggiunta di pembrolizumab alla chemioterapia ha aumentato i tassi di pCR nei pazienti con carcinoma mammario HR+/HER2 negativo, in stadio precoce ad alto rischio. Nell’analisi dello studio di fase 3 CheckMate 7FL (4), è stato riportato un aumento simile di pCR nei pazienti affetti da carcinoma mammario ER+/HER2 negativo, ad alto rischio, G2/3, che hanno ricevuto nivolumab + chemioterapia neoadiuvante rispetto a quelli che hanno ricevuto chemioterapia neoadiuvante (24,5% contro 13,8%; odds ratio = 2,05 (IC 95%, 1,29‒3,27); P = 0,0021).
Nella fase adiuvante dello studio KEYNOTE-756, i pazienti hanno ricevuto pembrolizumab o placebo in associazione alla terapia endocrina standard. Nonostante i risultati dello studio monarchE abbiamo evidenziato che l’aggiunta di abemaciclib alla terapia endocrina adiuvante aumenti la sopravvivenza libera da malattia (DFS) nei pazienti con carcinoma mammario HR+/HER2 negativo, N+, in stadio precoce ad alto rischio di recidiva (5), poiché il KEYNOTE-756 è stato disegnato prima che questi risultati venissero presentati, l’uso di abemaciclib adiuvante non era stato consentito dal protocollo del KEYNOTE-756. Comunque, dato che la pCR è stata valutata “prima” della fase adiuvante, l’uso di abemaciclib non avrebbe potuto influenzare il risultato dello studio KEYNOTE-756. Ad oggi, sebbene alcuni studi hanno valutato e riportato il profilo di sicurezza della combinazione di inibitori della chinasi ciclina-dipendente 4/6 con un inibitore del checkpoint immunitario in pazienti con carcinoma mammario metastatico HR+/, HER2 negativo, le attuali linee guida non raccomandano tale combinazione terapeutica.
I dati relativi al principale endpoint dello studio, la EFS, non sono ancora maturi. Il dato di EFS risentirà dell’effetto complessivo del regime terapeutico, sia quello neoadiuvante sia quello adiuvante. Lo studio non è stato progettato per discriminare il contributo di ciascun regime.
Gli eventi avversi nel braccio pembrolizumab + chemioterapia sono stati coerenti con i profili di sicurezza degli altri inibitori del checkpoint immunitario. Come nello studio KEYNOTE-522, non c’era evidenza che l’aggiunta di pembrolizumab alla chemioterapia neoadiuvante abbia aumentato la tossicità associata alla chemioterapia, e gli eventi più frequenti osservati in entrambi i bracci erano quelli associati alla chemioterapia, come alopecia, nausea e anemia. Le incidenze di eventi avversi di grado ≥ 3 correlati al trattamento e di eventi avversi responsabili della sospensione del trattamento erano moderatamente più alte nei pazienti trattati con pembrolizumab + chemioterapia. Come riportato da studi precedenti che hanno valutato anticorpi monoclonali anti-PD-1 e anti-PD-L1, gli eventi avversi con un potenziale meccanismo immuno-mediato si sono verificati più frequentemente nei pazienti trattati con pembrolizumab + chemioterapia rispetto a quelli trattati con chemioterapia. In generale, il profilo di sicurezza dello studio KEYNOTE-756 è stato coerente con quello dello studio KEYNOTE-522.
Conclusioni
Nello studio KEYNOTE-756, l’aggiunta di pembrolizumab alla chemioterapia neoadiuvante ha evidenziato un aumento statisticamente significativo del tasso di pCR rispetto alla sola chemioterapia nei pazienti con carcinoma mammario ER+/HER2-negativo in fase precoce, ad alto rischio di recidiva. La valutazione della EFS è ancora in corso.
Bibliografia
- Nanda, R. et al. Effect of pembrolizumab plus neoadjuvant chemotherapy on pathologic complete response in women with early-stage breast cancer: an analysis of the ongoing phase 2 adaptively randomized I-SPY2 trial. JAMA Oncol.6, 676–684 (2020).
- Schmid, P. et al. Pembrolizumab for early triple-negative breast cancer. N. Engl. J. Med.382, 810–821 (2020).
- Schmid, P. et al. Event-free survival with pembrolizumab in early triple-negative breast cancer.
- Loi, S. et al. LBA20 A randomized, double-blind trial of nivolumab (NIVO) vs placebo (PBO) with neoadjuvant chemotherapy (NACT) followed by adjuvant endocrine therapy (ET) ± NIVO in patients (pts) with high-risk, ER+ HER2− primary breast cancer (BC). Ann. Oncol.34, S1259–S1260 (2023).
- Johnston, S. R. D. et al. Abemaciclib plus endocrine therapy for hormone receptor-positive, HER2-negative, node-positive, high-risk early breast cancer (monarchE): results from a preplanned interim analysis of a randomised, open-label, phase 3 trial. Lancet Oncol. 24, 77–90 (2023).


