
ZOLBETUXIMAB PLUS mFOLFOX6 IN PATIENTS WITH CLDN18.2-positive, HER2-negative, UNTREATED, LOCALLY ADVANCED UNRESECTABLE OR METASTATIC GASTRIC OR GASTRO-OESOPHAGEAL JUNCTION ADENOCARCINOMA (SPOTLIGHT): A MULTICENTRE, RANDOMISED, DOUBLE-BLIND, PHASE 3 TRIAL.
Shitara K, Lordick F, Bang YJ, Enzinger P, Ilson D, Shah MA, Van Cutsem E, Xu RH, Aprile G, Xu J, Chao J, Pazo-Cid R, Kang YK, Yang J, Moran D, Bhattacharya P, Arozullah A, Park JW, Oh M, Ajani JA.
Lancet. 2023 May 20;401(10389):1655-1668. doi: 10.1016/S0140-6736(23)00620-7. Epub 2023 Apr 15.
Erratum in: Lancet. 2023 Jul 22;402(10398):290. doi: 10.1016/S0140-6736(23)01481-2. Erratum in: Lancet. 2024 Jan 6;403(10421):30. doi: 10.1016/S0140-6736(23)02762-9.
Zolbetetuximab in associazione a chemioterapia contenente fluoropirimidina e platino, è dal 5 maggio 2025 disponibile in Italia in Cnn (Classe C non negoziata) per il trattamento di prima linea di pazienti adulti affetti da adenocarcinoma gastrico o della giunzione gastro-esofagea (GGE) HER2 negativo localmente avanzato non resecabile o metastatico, i cui tumori sono positivi alla claudina (CLDN) 18.2 (≥75% di cellule tumorali che dimostrano una colorazione immunoistochimica da moderata a forte della CLDN18 di membrana, valutata mediante un dispositivo diagnostico in vitro (IVD) a marchio CE con la destinazione d’uso corrispondente o, se qualora non sia disponibile un IVD dotato di marcatura CE, si deve utilizzare un test convalidato alternativo), sulla base dei risultati dello studio di fase 3 SPOTLIGHT.
Introduzione
Zolbetuximab, un anticorpo monoclonale che ha come bersaglio la claudina-18 isoforma 2 (CLDN18.2), ha dimostrato efficacia nei pazienti con adenocarcinoma gastrico o della giunzione gastro-esofagea CLDN18.2-positivo, HER2-negativo, localmente avanzato, non resecabile o metastatico.
In questo lavoro vengono riportati i risultati dello studio SPOTLIGHT, che ha analizzato l’efficacia e la sicurezza di zolbetuximab + mFOLFOX6 (regime modificato di acido folinico, fluorouracile e oxaliplatino) in prima linea rispetto a placebo + mFOLFOX6 in pazienti con adenocarcinoma gastrico o della giunzione gastro-esofagea CLDN18.2-positivo, HER2-negativo, localmente avanzato non resecabile o metastatico.
Materiali e Metodi
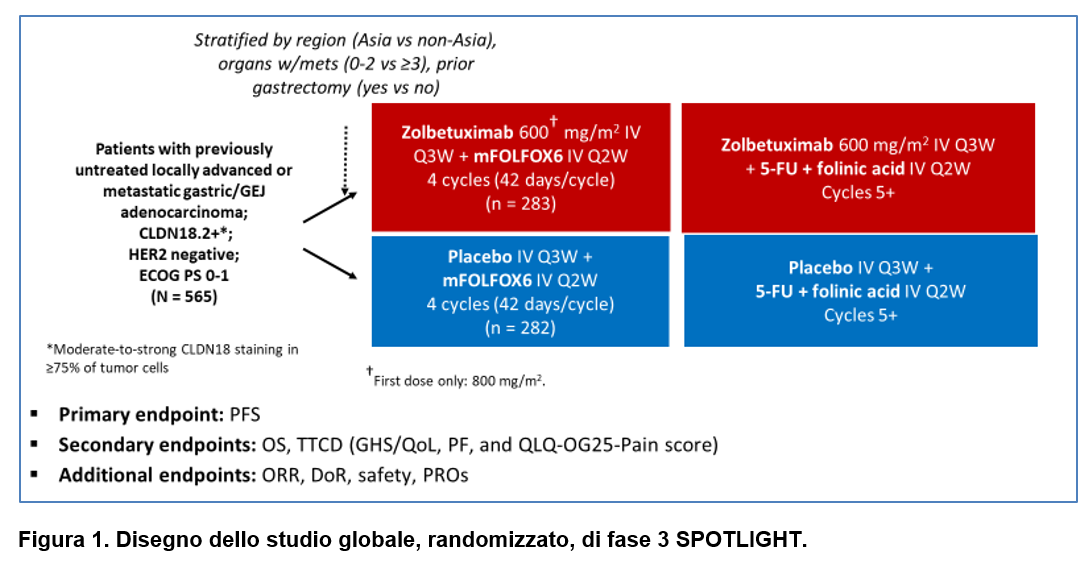
Il trial SPOTLIGHT è uno studio globale, randomizzato, controllato con placebo, in doppio cieco, di fase 3, che ha arruolato pazienti da 215 centri in 20 Paesi. I pazienti eleggibili erano di età pari o superiore a 18 anni con adenocarcinoma gastrico o della giunzione gastro-esofagea CLDN18.2-positivo (definito come ≥75% delle cellule tumorali che mostravano una colorazione CLDN18 membranosa da moderata a forte), HER2-negativo (sulla base di una valutazione locale o centrale), precedentemente non trattato, localmente avanzato, non resecabile o metastatico, con malattia valutabile radiologicamente (misurabile o non misurabile) secondo RECIST v1.1; PS ECOG pari a 0-1; adeguata funzionalità d’organo.
I pazienti sono stati randomizzati (1:1) a ricevere zolbetuximab (800 mg/m 2 dose di carico seguita da 600 mg/m 2 ogni 3 settimane) più mFOLFOX6 (ogni 2 settimane) o placebo più mFOLFOX6 (Figura 1).
I pazienti sono stati stratificati in base alla regione (Asia/non Asia), al numero di organi con metastasi (0-2 vs ≥3) e alla precedente gastrectomia (SI/NO).
L’endpoint primario era la sopravvivenza libera da progressione, valutata da un comitato di revisione indipendente in tutti i pazienti randomizzati (Figura 1).
La safety è stata valutata in tutti i pazienti trattati.
Lo studio è registrato su ClinicalTrials.gov, NCT03504397 e l’arruolamento dei pazienti è stato chiuso.
Risultati
Nel periodo 21 giugno 2018 e 1° aprile 2022, sono stati randomizzati 565 pazienti a ricevere zolbetuximab più mFOLFOX6 (283 pazienti; il gruppo zolbetuximab) o placebo più mFOLFOX6 (282 pazienti; il gruppo placebo). Almeno una dose di trattamento è stata somministrata a 279 (99%) dei 283 pazienti del gruppo zolbetuximab e a 278 (99%) dei 282 pazienti del gruppo placebo.
Nel gruppo zolbetuximab, 176 (62%) pazienti erano maschi e 107 (38%) femmine.
Nel gruppo placebo, 175 (62%) pazienti erano maschi e 107 (38%) femmine.
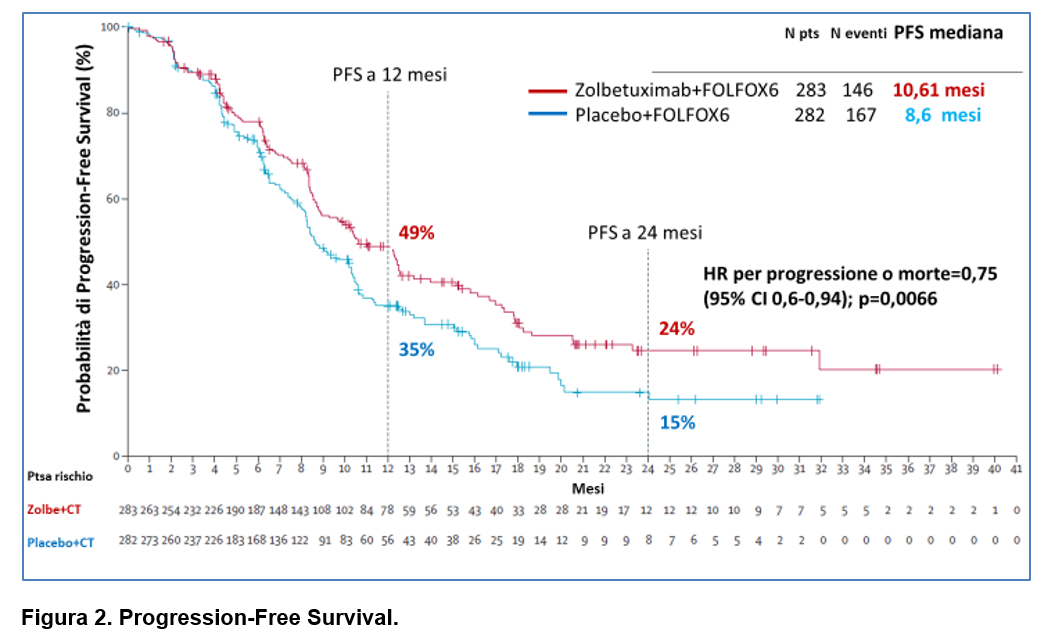
La durata mediana del follow-up per la sopravvivenza libera da progressione (PFS) è stata di 12,94 mesi nel gruppo zolbetuximab e di 12,65 mesi nel gruppo placebo.
Il trattamento con zolbetuximab ha dimostrato una riduzione significativa del rischio di progressione della malattia o di morte rispetto al placebo (HR= 0,75, 95% CI 0,60-0,94; p=0,0066).
La sopravvivenza mediana libera da progressione (PFS) è stata di 10,61 mesi (95% CI 8,90-12,48) nel gruppo zolbetuximab rispetto a 8,67 mesi (8,21-10,28) nel gruppo placebo (Figura 2).
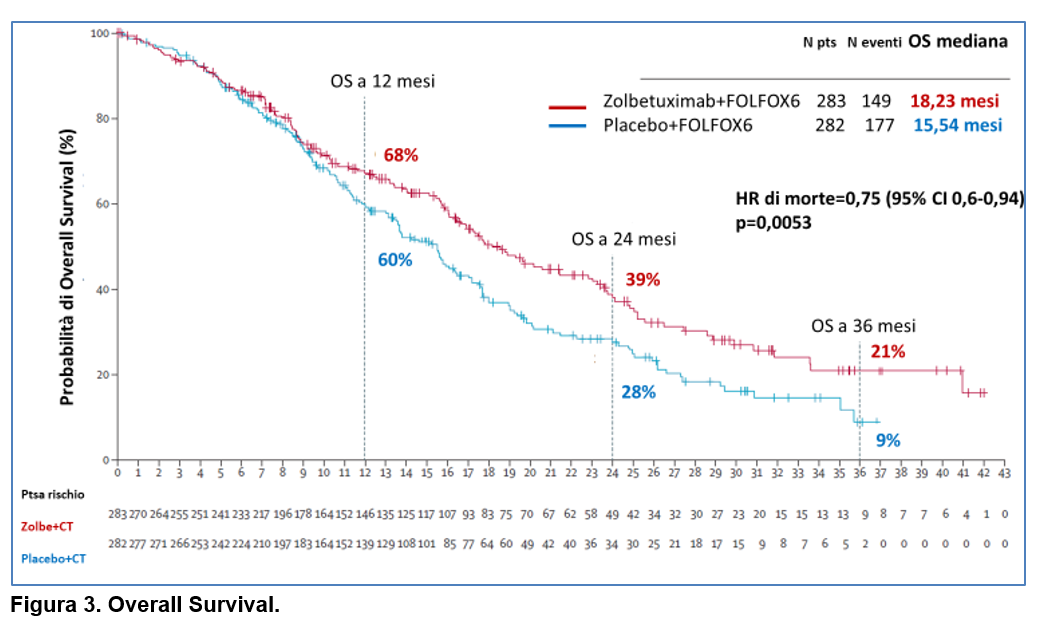
Il trattamento con zolbetuximab ha anche determinato una riduzione significativa del rischio di morte rispetto al placebo (HR 0,75, 95% CI 0,60-0,94; p=0,0053) (Figura 3).Eventi avversi di grado≥ 3 emersi durante il trattamento si sono verificati in 242 (87%) dei 279 pazienti del gruppo zolbetuximab rispetto a 216 (78%) dei 278 pazienti del gruppo placebo.
Gli eventi avversi più comuni con zolbetuximab + chemioterapia sono stati nausea, vomito e diminuzione dell’appetito.
I decessi correlati al trattamento si sono verificati in cinque (2%) pazienti nel gruppo zolbetuximab rispetto a quattro (1%) pazienti nel gruppo placebo. Non sono stati identificati nuove tossicità.
Conclusioni
La combinazione di zolbetuximab con chemioterapia (mFOLFOX6)- come trattamento di prima linea- ha prolungato significativamente la sopravvivenza libera da progressione e la sopravvivenza globale rispetto a placebo più mFOLFOX6 in pazienti con adenocarcinoma gastrico o della giunzione gastro-esofagea CLDN18.2-positivo, HER2-negativo, localmente avanzato non resecabile o metastatico.
COMMENTO
Zolbetetuximab in associazione a chemioterapia contenente fluoropirimidina e platino, è dal 5 maggio 2025 disponibile in Italia in Cnn (Classe C non negoziata) per il trattamento di prima linea di pazienti adulti affetti da adenocarcinoma gastrico o della giunzione gastro-esofagea (GGE) HER2 negativo localmente avanzato non resecabile o metastatico, i cui tumori sono positivi alla claudina (CLDN) 18.2 sulla base dei risultati dello studio di fase 3 SPOTLIGHT.


